|
Fenoli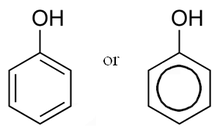 I fenoli sono sostanze derivate dagli idrocarburi aromatici per la sostituzione di uno o più atomi di idrogeno con gruppi ossidrile -OH.[1] Capostipite di questa classe, da cui prende anche il nome, è il fenolo, di formula C6H5OH, in cui un atomo di idrogeno del benzene è sostituito da un gruppo -OH. Come gli alcoli sono ossidabili; in particolare si comportano come alcoli alifatici terziari, in quanto per ossidazione la molecola viene spesso completamente degradata. Sono più acidi di altri alcoli: l'anione che si forma per perdita dell'idrogeno del gruppo -OH è particolarmente stabile, dato che la risonanza disperde la carica elettrica negativa su tutto l'anello aromatico. La presenza di gruppi elettron-attrattori migliora l'effetto di dispersione della carica aumentando l'acidità del composto. Analogamente, gruppi elettron-repulsori rendono invece più difficile disperdere la carica negativa e quindi diminuiscono l'acidità.
I fenoli subiscono facilmente reazioni di sostituzione elettrofila nelle posizioni orto e para. Proprietà fisiche di fenoli e fenoleteriI fenoli sono generalmente composti cristallini con punti di fusione relativamente bassi ed odore molto caratteristico. Il fenolo fonde a circa 40,9 °C ma spesso si presenta in forma semiliquida, a causa dell'acqua assorbita che ne abbassa di parecchio il punto di fusione, tant'è che basta una percentuale del 7-8% di quest'ultima perché il composto si presenti totalmente allo stato liquido. Il fenolo è poco solubile in acqua fredda (6,7 g/L) ma totalmente miscibile con acqua calda. Sia fenoli che cresoli sono usati come disinfettanti commerciali. I fenoleteri di basso peso molecolare sono liquidi e, non potendo formare legami idrogeno se non deboli mancando dell'ossidrile, sono insolubili in acqua. Anche l'ossigeno non può essere coinvolto in legami idrogeno particolarmente intensi a causa della sua bassa basicità causata dalla coniugazione di un doppietto libero con l'anello aromatico. Nomenclatura dei fenoliIl termine fenolo deriva dalla fusione dei due sostantivi fenile ed enolo. Il fenolo può infatti essere considerato come un enolo, avendo un doppio legame vicino all'ossidrile. Al contrario dei chetoni, dove l'equilibrio è spostato verso la struttura chetonica, nei fenoli prevale la forma enolica a causa del grande effetto stabilizzante dell'aromaticità della molecola, che si perderebbe nella forma carbonilica. Dato che nel termine fenolo il gruppo funzionale è considerato come un suffisso, la IUPAC ha deliberato che tutti i composti derivati possono essere chiamati come tali. Il Chemical Abstracts usa il termine fenolo per riferirsi al composto base mentre gli altri sono considerati derivati del benzenolo. Ecco alcuni esempi: I gruppi come il solfonico ed il carbossilico sono considerati prioritari, per cui quando un fenolo contiene tali gruppi l'ossidrile è indicato con il prefisso idrossi- come nel caso degli altri alcool. I fenileteri sono chiamati come alcossi areni sebbene sporadicamente si utilizzi comunque il termine etere. Essendo largamente diffusi in natura, molti composti fenolici hanno assunto nomi d'uso che è bene conoscere. Ecco alcuni dei principali: Notare come nel caso in cui l'anello presenti due ossidrili non venga usato il termine fendiolo ma venga usato il prefisso diidrossi- Sintesi dei fenoli
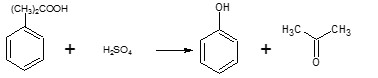
Sintesi industrialeIndustrialmente il fenolo è ottenuto con un processo che comporta l'ossidazione del cumene, un idrocarburo che può essere ottenuto semplicemente e soprattutto economicamente per alchilazione del benzene. Il cumene è un idrocarburo instabile che reagisce rapidamente con l'ossigeno atmosferico ossidandosi ad idroperossido di cumene. Questo tipo di ossidazione è resa facile dal fatto che l'intermedio radicalico principale è un radicale cumile non solo terziario ma anche aromatico, quindi estremamente stabile. L'idroperossido può quindi venir trattato con acido solforico per dare fenolo e acetone. Sintesi dei fenoleteriNel caso di eteri aril metilici il reagente migliore è il solfato dimetilico;
Reazioni dello ione fenossido
La reazione è tuttavia poco controllabile e spesso porta a prodotti polimerici. In condizioni particolari la reazione tra fenolo e formaldeide porta alla bakelite, una delle prime materie plastiche. Questo genere di polimeri è definito come quello delle resine fenolo-formaldeide.
BiochimicaI composti fenolici sono ampiamente diffusi in natura e rappresentano un'importante classe di metaboliti secondari. In molti casi la funzione ossidrilica è mascherata da una O-metilazione oppure da una O-glicosilazione. La diffusione dei fenoli è comune in tutto il regno vivente ma la maggior distribuzione appartiene al regno vegetale ed in particolare nei tessuti vegetali. In questi sono responsabili di molte caratteristiche organolettiche, fitoterapiche e cromatiche; ad esempio ai tannini si riconoscono qualità astringenti, agli antociani il colore dei fiori, agli acidi fenolici il sapore acidulo, ad alcuni flavonoidi il sapore amaro. Trovano impiego come anestetici e per problemi locali della cute. Pur essendo i fenoli poco volatili, i sintomi da esposizione acuta riguardano la presenza di ustioni indolori, depigmentazione e irritazione dei tessuti (a partire dalla cute) e dell'iride degli occhi, tachicardia e ipotensione, eccitazione e depressione del sistema nervoso. In concentrazioni superiori al 5%, in particolare idrochinone e il dinitrofenolo, denaturano rapidamente qualsiasi proteina cui vengono a contatto, oltre a stimolare il rilascio di acetilcolina nella giunzione neuromuscolare, e causare metaemoglobinemia[2]. Inoltre, studi sul carvacrolo mostrano che vari fenoli inibiscono l'enzima acetilcolinesterasi. ClassificazioneLe principali classi di composti fenolici nelle piante si suddividono in:
I composti fenolici si accumulano in genere in tutti gli organi della pianta, con la maggior parte dei fenoli presenti negli strati epidermici e subepidermici in relazione all'effetto induttore della luce sul metabolismo fenolico, nonché con il ruolo protettivo esercitato dai composti fenolici nei confronti delle radiazioni ultraviolette. DistribuzioneLa distribuzione delle classi dei fenoli nel regno vegetale, allo stato attuale, è la seguente:
Fenoli sempliciI fenoli semplici come lo sono il Cresolo, il Guaiacolo, il Floroglucinolo, il Catecolo, non sono frequenti nei tessuti. Il più raro è il Resorcinolo ritrovato in aghi di Pinus rigida, mentre il più comune è l'Idrochinone. Alcuni chinoni (Plastochinone, Ubichinone, etc.) presenti nei cloroplasti e nei mitocondri delle cellule vegetali, sono coinvolti nelle reazioni del metabolismo primario. Acidi fenoliciNe fanno parte aldeidi fenoliche o fenolate comuni in molti olii essenziali, quali salicilaldeide, 4-idrossibenzaldeide, p-anisaldeide, aldeide protocatecuica e la più diffusa vanillina. Quali acidi ne fanno parte invece l'acido salicilico, l'acido 4-idrossibenzoico, l'acido protocatecuico, l'acido vanillico, l'acido siringico, distribuiti nelle piante soprattutto come esteri O-glicosidici o come costituenti della frazione alcool-insolubile dei tessuti vegetali (ad esempio legati alla lignina). L'acido gallico è comune nelle specie legnose. Note
Bibliografia
Voci correlateAltri progetti
|