|
Cisztationin-γ-liáz
A cisztationin-γ-liáz (EC 4.4.1.1; röviden CTH vagy CSE, más néven cisztationáz), szabályos nevén l-cisztationin-cisztein-liáz (dezamináló, 2-oxobutanoát-képző)) a cisztationint ciszteinné, 2-oxobutanoáttá és ammóniává bontja:
A piridoxál-foszfát az enzim prosztetikus csoportja.[1][2][3] A cisztationin ezenkívül az alábbi eliminációkat is katalizálja:
Egyes baktériumokban és emlősökben, beleértve az embert is, ez az enzim kén-hidrogént is létrehoz.[2][5] Ez a sejtek jelzésében résztvevő kevés gáz egyike.[6] EnzimmechanizmusA cisztationáz piridoxál-foszfátot használ a cisztationin S–γ-C kötésének felbontását könnyítendő, ciszteint felszabadítva.[3] A lizin a belső aldimint α-iminovajsav felszabadításával hozza újra létre. Ezután a külső ketimin hidrolízise történik, 2-oxobutirátot adva.[7] A cisztationin aminocsoportja deprotonálódik, és a nukleofil belső aldiminnel reagál. Egy általános bázis általi újabb deprotonáció a külső aldimin keletkezését és a lizin eltávolítását okozza. A lizin ezután deprotonálhatja az α-szénatomot, az elektronsűrűséget a piridin nitrogénjére helyezve.[3] A piridoxál-foszfát a karbanion köztitermék stabilizálásához kell, különben a proton pKa-ja túl magas lenne.[7] A β-C deprotonálódik, α–β-telítetlenséget okozva, és egy magányos párt az aldiminnitrogénhez tolva. Az aldimin újbóli létrehozásához e pár visszakerül, a S–γ-C kötést felbontva, ez ciszteint ad.[3] A vinil-glioxilát piridoxaminszármazéka marad fenn a γ-elimináció után. A magányos pár a pirdin nitrogénjéről az elektronsűrűséget a γ-C felé tolja, ezt a lizin protonálja. A lizin reagál a külső aldiminnel, az elektronsűrűséget a β-C felé tolva, melyet egy általános sav protonál. Az imin hidrolízisével 2-oxobutirát keletkezik. A lizin deprotonálása ammónia távozását okozza, a katalitikus ciklust lezárva.[7] A cisztationin-γ-liáz γ-szintázként is működhet a jelenlévő kiindulási anyagok mennyiségétől függően.[8] A mechanizmusok a vinil-glioxilát-származékig azonosak. A γ-szintáz-mechanizmusban a γ-C-nel kénnukleofil reagál, S–γ-C kötést létrehozva.[7][8]  SzerkezeteA cisztationin-γ-liáz a Cys/Met metabolizmus PLP-dependens enzimjeinek családjának tagja. További tagok például a cisztationin-γ-szintáz, a cisztationin-β-liáz és a metionin-γ-liáz.[8] Tagja továbbá a nagyobb aszpartát-aminotranszferáz-családnak.[1][8] Sok más PLP-dependens enzimhez hasonlóan a cisztationin-γ-liáz D2 szimmetriájú tetramer fehérje.[8] A piridoxál-foszfátot az aktív helyen a Lys212 köti meg.[2] Kapcsolata betegségekkel A cisztein a szemben lévő glutationszintézis sebességkorlátozó szubsztrátja. A glutation antioxidáns, mely a szem krisztallinjait védi a reaktív oxigénszármazékoktól, a denaturált krisztallinok kataraktákat okozhatnak. A cisztaionáz is reagál a reaktív oxigénszármazékokkal. Így a cisztationáz oxidációjakor aktivitása csökken, csökkentve a szem cisztein-, így a glutationkoncentrációját is, csökkentve az antioxidáns aktivitást, tovább csökkentve a cisztationázaktivitást. A cisztationáz csökkent aktivitása van jelen rákos és AIDS-es betegekben is[9] A cisztationáz mutációi és hiányai és a cisztationinuria közt kapcsolatot mutattak ki. A T67I és a Q240E mutációk csökkentik az enzim affinitását a piridoxál-foszfáthoz, mely a működéséhez fontos kofaktor.[2] Az alacsony H2S-szint összefügg egerekben a magas vérnyomással.[10] 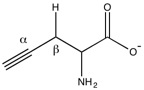 A nagy cisztationázaktivitás okozta magas H2S-szint összefügg az endotoxémiával, az akut hasnyálmirigy-gyulladással, a vérzéses sokkal és a diabetes mellitusszal.[2] A propinilglicin és a β-cianoalanin a cisztationáz két irreverzibilis inhibitora, melyek a megnövekedett H2S-szintekre használatosak. A propinilglicin aminocsoportja az aldimint támadja külső aldimint adva. Az alkin β-szénatomja deprotonálódik diént adva, melyet a Tyr114 fenolja támadja. A belső aldimin regenerálódhat, de a vinil-éter sztérikusan gátolja az aktív helyet, így a piridoxál-foszfáttal nem reagálhat a cisztein.[2] SzabályzásA H2S csökkenti a cisztationáz transzkripcióját 10-80 μM közti koncentrációban, azonban 120 μM körüli koncentrációkban ismét növekszik, 160 μM felett megszűnik a transzkripció.[6] Jegyzetek
Fordítás
További információk
|
||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia
