|
Streptocoque BS. agalactiae
Streptococus agalactiæ
Les streptocoques du groupe B (SGB) (Group B Streptococcus (GBS) sont un groupe de streptocoques dans lequel Streptococcus agalactiae (S.agalactiae) est le principal représentant[1]. Il s'agit d'une coque (bactérie ronde) à Gram positif qui, au microscope, est disposé en chaînes (streptocoques), Le SGB possède une capsule bactérienne polysaccharidique riche en acide sialique et selon sa structure, on distingue 10 sérotypes antigéniquement différents (Ia, Ib, II-IX)[2]. Le SGB est un constituant du microbiote intestinal humain (flore intestinale), normal de l'intestin de l'homme et des autres animaux Il s'agit d'une bactérie qui peut provoquer des infections très graves, chez les nouveau-nés et les adultes. Les premiers cas d’infection néonatale à streptocoques du groupe B ont été décrits par Eickhoff en 1964[3]. C'est aussi un pathogène important en médecine vétérinaire, car il provoque la mammite bovine (inflammation du pis) chez les vaches laitières. Son nom y fait allusion («agalactiae» signifie «absence de lait»).  Caractères bactériologiques particuliers des streptocoques du groupe B. Identification en laboratoireLe SGB se développe sous forme de colonies bêta-hémolytiques sur gélose au sang (entourées d'un petit halo de β-hémolyse) il existe même des souches (1-2%) qui ne sont pas du tout hémolytiques. S.agalactiae est catalase négative, oxydase négative et anaérobie facultative, et se caractérise par la présentation du groupe B des antigènes du système de Lancefield sur sa paroi bactérienne, et peut être identifie en détectant l'antigène du groupe B par agglutination au latex avec des antisérums spécifiques[4]. 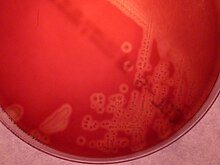  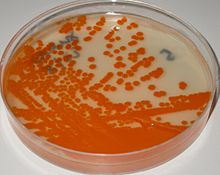 D’autres tests permettant d’identifier le SGB sont la détection de l’hydrolyse de l’hippurate et le CAMP-test, qui provoque la lyse des érythrocytes de bovins ou d’agneau préalablement sensibilisés par la sphingomyélinase produite par Staphylococcus aureus[5].  Les souches hémolytiques de SGB cultivées sur gélose Granada se développent sous forme de colonies rouges car elles produisent un pigment polyène rouge non isoprénoïde – le grenadaène, spécifique du SGB, qui permet son identification immédiate[6],[7]. L'identification du SGB peut également être réalisée à l'aide de la technique MALDI-TOF (Matrix Assisted Laser Desorption Ionization - Time of Flight Mass Spectrometry)[8].  L'identification « provisoire » du SGB est également possible par l'apparition de ses colonies sur un milieu chromogène spécifique où il se développe sous forme de colonies de couleurs différentes selon le milieu utilisé. S'ils sont utilisés des milieux de culture (gélose) chromogéne pour la détection et l'identification du SGB, il convient de toujours confirmer que les colonies suspectes (ayant l'apparence du SGB) sont bien du SGB en utilisant une technique d'identification sécurisée, par ex. détection des pigments (gélose Granada), agglutination au latex, le CAMP-test ou MALDI-TOF[4],[9]. Le SGB peut être retrouvé, commensal, sans provoquer de maladie (microbiote normal), dans les voies digestives, urinaires et génitales chez jusqu'à 30 % des adultes (colonisation (biologie)), y compris les femmes enceintes[10],[11]. Cependant, occasionnellement, le SGB est capable de contournant les mécanismes de défense de l'hôte humain, envahissant les tissus et provoquant des infections graves (infection streptococcique du groupe B). Parmi les principaux facteurs de virulence du SGB, on peut citer le polysaccharide capsulaire et la bêta-hémolysine (considérée comme identique au pigment). La capsule du SGB est probablement le facteur de virulence le plus important car elle permet au SGB d'éviter l'action des mécanismes de défense de l'hôte en interférant avec la capacité des phagocytes humains à phagocyter et à détruire les bactéries[12],[13],[14]. Colonisation et infection chez la mère et le nouveau-néDes taux de colonisation du SGB chez les femmes enceintes (sans provoquer d'infection) (porteur sain) ont été publiés entre 4 et 36 %, deux études récentes sur le taux global de colonisation par le SGB utilisant une méta-analyse ont indiqué des pourcentages de colonisation de 14, 6 % et 18 %. De grandes variations existent entre les pays et même entre les régions d’un même pays. Cette variation dans les données publiées peut être due à des méthodes d’étude différentes et à des différences dans les populations étudiées[11],[15],[16],[17]. Bien que la colonisation par le SGB ne provoque normalement pas de symptômes ou de problèmes chez les femmes en bonne santé pendant la grossesse, elle peut provoquer des maladies graves chez la mère et le bébé pendant la grossesse et après l'accouchement et a été associée à la mort fœtale et à la naissance prématuré[10],[18],[19]. L'infection à SGB peut rarement provoquer une chorioamniotite (infection grave des membranes placentaires) et une infection post-partum (après la naissance). Les infections des voies urinaires à SGB peuvent déclencher le travail et provoquer un accouchement prématuré[10]. Chez le nouveau-né, l'infection à SGB provoque deux syndromes cliniques différents: une infection néonatale précoce, le syndrome précoce (Early onset disease, EOD) et une infection néonatal tardive, le syndrome tardif (Late Onset Disease, LOD)[10],[20]. Le syndrome précoce se développe au cours des sept premiers jours de la vie; près de 80% des cas, dans les premières 24 heures, presque toujours sous la forme d’une sepsis, d’une pneumonie ou d’une méningite. Les nouveau-nés peuvent contracter l’infection in utero ou plus fréquemment en passant par le tractus génital lors de l’accouchement. La transmission verticale (mère-nouveau-né) se produit lors de l'accouchement et environ 50 % des nouveau-nés de mères colonisées par le SGB le sont également. En l’absence de mesures de prévention, 1 à 2 % des nouveau-nés de mères colonisées développent un syndrome précoce[21]. Dans les pays développés, le SGB est la cause la plus fréquente d'infection bactérienne grave chez les nouveau-nés, de septicémie (sepsis), de pneumonie et de méningite, pouvant entraîner la mort ou des séquelles permanentes[10]. Aux États-Unis, l'incidence du syndrome précoce avant la mise en œuvre des mesures de prévention était de 0,7 à 3,7 pour mille nouveau-nés et en Europe, entre 0,2 et 3,25 pour mille nouveau-nés[10],[15]. Divers facteurs favorisent le développement d’une infection précoce à SGB chez un nouveau-né dont la mère est colonisée par le SGB. Bien que le risque fondamental pour le nouveau-né de développer une infection néonatale due au SGB soit la colonisation de la mère[18],[22]. D'autres facteurs de risque favorisent le développement d’une infection précoce à SGB comprennent la prématurité, la chorioamnionite maternelle, la rupture prolongée des membranes (plus de 18 heures), la fièvre intrapartum, une bactériurie à SGB pendant la grossesse et un ancien frère ou une sœur ayant souffert un syndrome précoce. Un autre facteur de risque important est l’exposition à une concentration élevée de SGB dans le canal génital. Cependant, la majorité des nouveau-nés qui développent un syndrome précoce sont nés de mères qui ne présentent aucun de ces facteurs de risque[18]. La mortalité due au syndrome précoce, qui était de 50 % dans les années 1970, a actuellement diminué dans les pays développés pour atteindre 4 à 8 %, principalement en raison des progrès des soins néonatals, et elle est plus élevée chez les nouveau-nés prématurés[22]. Le syndrome tardif est défini par une infection débutant au-delà de la première semaine de vie et pouvant survenir jusqu’à plusieurs mois après la naissance, se présentant généralement sous la forme d’une bactériémie ou d’une méningite sans que le mécanisme de l’infection soit connu dans la plupart des cas. Lorsque le syndrome tardif se présente comme une méningite, des séquelles permanentes telles que surdité ou retard mental sont fréquentes[10],[23]. Des estimations récentes estiment que dans le monde, chaque année, 400 000 nouveau-nés développent une infection précoce ou tardive au SGB, avec environ 90 000 décès[24],[25]. En Espagne, une incidence de 0,17 pour mille nouveau-nés pour le syndrome précoce à SGB et de 0,05 pour mille pour le syndrome tardif été publiée pour 2018[26]. Prévention de l’infection néonatale précoce à SGBLa seule alternative qui, jusqu'à présent, s'est révélée efficace pour prévenir une infection néonatale précoce par le SGB est d'administrer un antibiotique approprié (antibioprophylaxie per-partum) (intrapartum antibiotic prophylaxis, IAP) par voie intraveineuse (IV) à la femme enceinte colonisée par le SGB pendant au moins 4 heures avant la fin de l'accouchement. Ce comportement réduit la transmission du SGB au nouveau-né et empêche le nouveau-né de développer une infection par le SGB[18]. Les antibiotiques utilisés sont la pénicilline G aux doses de 5 millions d'UI, puis 2,5 millions d'UI en intraveineuse toutes les 4 heures jusqu’à l’expulsion ou ampicilline, 2 g IV initial dose, puis 1 g IV toutes le 4 h jusqu’à l’expulsion. En cas d'hypersensibilité (allergie réaction) a la pénicilline, les alternatives sont, clindamycine ou vancomycine. Dans ce cas un antibiogramme doit être réalisé en raison de la résistance de certaines souches de SGB à la clindamycine[18],[22],[27]. Pour sélectionner les mères candidates à recevoir antibioprophylaxie per-partum, il existe deux stratégies. L’une repose sur la détection des porteurs du SGB entre 35 et 37 semaines de grossesse (dépistage universel) et l’administration d`antibioprophylaxie per-partum pendant l’accouchement à toutes les mères colonisées par le SGB. Additionnellement, antibioprophylaxie per-partum doit être administrée aux femmes enceintes qui présentent des facteurs de risque et dont le statut de porteuse du SGB est inconnu au moment de l'accouchement. L'autre stratégie sélectionne les candidats pour recevoir antibioprophylaxie sur la base de la seule présence des facteurs de risque susmentionnés[18],[22]. Aux États-Unis, les Centers for Disease Control and Prevention (CDC) ont publié en 2010 leurs recommandations actualisées pour la prévention de l’infection néonatale à SGB[22]. En 2018, le CDC a transféré la mise à jour de ses recommandations à l'American College of Obstetricians and Gynecologists (ACOG), à l'American Academy of Pediatrics et à l'American Society of Microbiology (ASM), qui ont publié en 2019 et 2020 des documents actualisés de recommandations pour la prévention d’une infection néonatale à SGB[18],[27],[28]. Le document de l'ACOG n'introduit pas de nouveaux développements importants concernant les recommandations du CDC. La nouveauté est la recommandation d'effectuer la détection du SGB chez les femmes enceintes à la semaine 36-37 au lieu de 35-37[29]. Son objectif est de rendre valide la détection du SGB jusqu'à ce que les accouchements soient couverts à la semaine 41, étant donné la validité des tests de détection du SGB chez la femme enceinte pendant seulement 5 semaines[30],[31]. La stratégie de dépistage universel est suivie dans plus de 35 pays dont la plupart des pays occidentaux comme la France, les États-Unis, l'Espagne, la Belgique, le Canada, l'Australie, l'Argentine, etc. La stratégie basée sur les facteurs de risque est suivie dans l'UE au Royaume-Uni et aux Pays-Bas[15],[32],[33]. Cette stratégie semble moins efficace puisque plus de la moitié des cas d’infection précoce surviennent chez des nouveau-nés de femmes enceintes sans facteurs de risque apparents[34]. Mais malheureusement, la prophylaxie intrapartum n’est pas efficace pour prévenir les infections néonatales tardives[15],[18]. Recherche du portage du streptocoque du groupe B pendant la grossessePuisque l'état de de porteur du SGB pendant la grossesse puisse être intermittent, il est admis que les cultures vagino-rectales destinées à détecter la colonisation du SGB effectuées moins de 5 semaines avant l'accouchement prédisent de manière adéquate l'état de de porteur du SGB pendant l'accouchement. Cependant, les cultures réalisées avant 5 semaines ne sont pas fiables[18],[22],[30],[31],[35]. Les dernières recommandations de l'ACOG recommandent de réaliser la culture pour détecter le SGB entre les semaines 36 et 37 de grossesse. Cette nouvelle recommandation prévoit une période de cinq semaines pour obtenir des résultats de culture valides, qui inclut les naissances survenant jusqu’à un âge gestationnel d’au moins 41 semaines[18],[22].  Les échantillons recommandés pour la culture du SGB sont des écouvillons prélevés dans le tiers externe du vagin (sans utiliser de spéculum) et dans la zone ano-rectale, en introduisant l'écouvillon dans le sphincter externe de l'anus. Pour le prélèvement, un seul écouvillon peut être utilisé en prélevant d'abord le prélèvement vaginal puis le prélèvement rectal. Pour le prélèvement d'échantillons, il est préférable d'utiliser des écouvillons « floqués » qui permettent une meilleure libération de l'échantillon dans le milieu de culture. Les échantillons prélevés au niveau du col de l'utérus, du périnée ou de la région périanale ne sont pas appropriés. Les échantillons peuvent être prélevés par des professionnels de la santé ou par la femme enceinte elle-même après information adéquate. Le recueil des exsudats vagino-rectaux doit être effectué avant toute manipulation vaginale, sans avoir utilisé de produits d'hygiène intime féminine et sans traitement antibactérien[28],[36]. Les écouvillons doivent être placés dans un moyen de transport adéquat et, si possible, conservés au réfrigérateur jusqu'à leur envoi au laboratoire auquel ils doivent être adressés dans les plus brefs délais (en moins de 24 heures). Les prélèvements (écouvillons vaginaux, rectaux ou vagino-rectaux) doivent être inoculés dans un bouillon de culture d'enrichissement sélectif pour le SGB (bouillon Todd Hewitt avec antibiotiques). Cela favorise le développement du SGB, tout en empêchant la croissance d’autres bactéries présentes dans l’échantillon qui pourraient interférer avec la détection du SGB. Après incubation du bouillon d'enrichissement (18-24h, 35-37°C), il est repiqué sur des plaques de gélose au sang et les colonies ressemblant à du SGB sont identifiées avec le test CAMP, a test d'agglutination au latex ou MALDI-TOF. Après incubation, le bouillon d'enrichissement peut également être sous-cultivé sur un milieu gélosé Granada où le SGB se développe sous forme de colonies rouge-rosé, et d'autres tests d'identification ne sont pas nécessaires[4],[6]. Le bouillon d'enrichissement peut également être sous-cultivé dans des géloses chromogène, où le SGB se développe sous forme de colonies colorées. Si un milieu chromogène est utilisé pour la détection du SGB, il faut confirmer que les colonies suspectes (ayant l'apparence du SGB) sont bien du SGB à l'aide d'une procédure de confirmation appropriée, par ex. agglutination au latex ou test CAMP, pour éviter les identifications erronées Il est également possible d'inoculer directement les écouvillons avec des prélèvements vaginaux, rectaux ou vagino-rectaux sur une plaque d'un milieu de culture approprié au SGB (gélose au sang, milieu Granada ou milieu chromogène). Cependant cette méthode (en omettant l'étape d'enrichissement sélectif) peut donnent lieu à quelques résultats faussement négatifs et il est conseillé d'utiliser cette méthode (sans bouillon d'enrichissement) en complément de l'inoculation en bouillon d'enrichissement sélectif[4],[28]. Pour détecter le SGB dans les échantillons vaginaux et rectaux, des tests d'amplification des acides nucléiques telles que la réaction en chaîne par polymérase (PCR) peuvent également être utilisées directement – ou après une phase d’enrichissement par culture en bouillon sélectif. Des tests rapides pour détecter le SGB (principalement des tests d'amplification des acides nucléiques) pourraient être efficaces à l'avenir en remplacement de la culture pour détecter les mères porteur sain du SGB. Mais ces tests doivent encore être améliorés pour pouvoir être utilisés comme tests sur le lieu d'intervention (Point-of-Care Testing, POCT), qui peuvent être effectués en salle d'accouchement et remplacer le dépistage du SGB par culture. Un autre inconvénient de ces techniques est qu'elles ne permettent pas de connaître la sensibilité aux antibiotiques de la souche SGB, ce qui constitue un problème sérieux en cas d'allergie à la pénicilline[18],[22],[28]. L’infection chez l’adulte, en dehors de la grossesseLe SGB est également capable de provoquer des infections graves chez les adultes, principalement personnes âgées, les personnes présentant des pathologies sous-jacentes comme l'obésité, le diabète, la cirrhose, l'âge avancé, le cancer et chez les sujets sous traitements immunosuppresseurs. Chez l’adulte, les infections à SGB les plus fréquentes sont les infections des voies urinaires hautes, les infections de la peau et des tissus mous (cellulite), les septicémies, l'ostéomyélite les pneumonies, les arthrites, et l´endocardite[37],[38]. Les bêta-lactame constituent les antibiotiques de choix pour le traitement des infections à SGB. Une association avec des aminosides (pour obtenir une synergie) peut être utilisée dans le traitement des infections graves. L’incidence des infections invasives à SGB chez l’adulte est en augmentation ces dernières années et sa morbidité et sa mortalité élevées rendent encore plus nécessaire le développement d’un vaccin pour prévenir ces infections[39],[40]. Perspectives vaccinalesBien que pour l'utilisation généralisée de l’antibioprophylaxie per-partum pour la prévention du syndrome précoce soit associée à une forte baisse de l'incidence de la maladie, il n'existe cependant aucune stratégie efficace pour prévenir le syndrome tardif et l’infection chez l’adulte L’alternative la plus efficace pour prévenir l’infection par le SGB serait le développement d’un vaccin qui pourrait prévenir les syndromes précoce et tardives ainsi que l’infection chez les adultes. Ce vaccin administré à la mère protégerait le nouveau-né contre une infection précoce au SGB et également contre une infection tardive, et pourrait également protéger les adultes âgées et les personnes présentant des pathologies sous-jacentes. Le polysaccharide de capsules de différents sérotypes de SGB, qui, comme indiqué, est un facteur de virulence important, est un excellent candidat pour le la mise au point d'un vaccin efficace pour prévenir l'infection par SGB. Déjà en 1976, il avait été démontré que la présence de faibles niveaux d'anticorps contre le polysaccharide de la capsule SGB dans le sérum des mères était liée à la susceptibilité du nouveau-né à souffrir d'une infection néonatale précoce ou tardive au SGB[41]. Des essais cliniques avec administration de candidats vaccins préparés à base de capsules de différents sérotypes de SGB ont été réalisés, démontrant que la capsule constitue effectivement un candidat intéressant pour la mise au point d'un vaccin dirigé contre SGB[15],[42]. Actuellement, outre les vaccins basés sur les polysaccharides de capsules, des vaccins à base des protéines de surface du SGB sont en cours de développement[43]. Mais malgré l’existence d’études et d’essais cliniques avancés il n’existe pas actuellement de vaccin disponible pour une utilisation généralisée pour la prévention des infections à SGB[15],[20],[43],[44],[45]. Infection à SGB chez les animauxLe SGB a été trouvé chez de nombreux mammifères et autres animaux tels que les chameaux, les chiens, les chats, les phoques, les dauphins et les crocodiles[46]. BovinsChez les bovins, le SGB provoque une mammite, une infection de la mamelle. Il peut provoquer une maladie fébrile aiguë ou une maladie subaiguë, plus chronique. Les deux conduisent à une diminution de la production de lait (d'où son nom : agalactiae qui signifie « pas de lait »). La mammite associée au SGB peut avoir un effet important sur la quantité et la qualité du lait produit et est également associée à un nombre élevé de cellules somatiques et à un nombre augmenté de bactéries dans le lait. Les épidémies dans les fermes laitières sont courantes, ce qui est d'une importance majeure pour l'industrie laitière. Des programmes visant à réduire l'impact du SGB ont été mis en œuvre dans de nombreux pays. Ces programmes ont conduit à la quasi-élimination de la mammite bovine à SGB au Royaume-Uni, en Europe du Nord et au Canada[47],[48],[49]. PoissonsLe SGB provoque de graves épidémies chez les poissons d’élevage, provoquant une septicémie et des hémorragies externes et internes, entraînant de graves pertes économiques. Les épidémies de SGB dans l`aquaculture de tilapia peuvent entraîner des maladies graves avec des taux de mortalité allant jusqu'à 80 %[50]. Des vaccins pour protéger les poissons contre les infections à SGB sont en cours de développement[51],[52]. Notes et références
|
