|
Réaction de BergmanLa réaction de Bergman ou cyclisation de Bergman, du nom du chimiste américain Robert G. Bergman, est une réaction de réarrangement en chimie organique de l'énédiyne en un dérivé radicalaire du benzène[1].  La réaction procède par pyrolyse (au-delà de 200 °C) en formant un composé diradicalaire 1,4-benzènediyle, espèce très réactive. Cette dernière réagit avec des donneurs de radicaux hydrogène tels que le cyclohexa-1,4-diène pour donner l'arène correspondant. Par traitement avec le tétrachlorométhane on obtient le 1,4-dichlorobenzène, et avec le méthanol, l'alcool benzylique. Quand l'ényne fait partie d'un cycle à 10 carbones (par exemple le cyclodéca-3-ène-1,5-diyne de la figure ci-dessous), la réaction peut s'effectuer à des températures bien plus basses (37 °C ici) grâce à la tension de cycle.  Des composés naturels tels que la calicheamicine contiennent ce même motif cyclique à 10 carbones et sont cytotoxiques. Ils génèrent l'intermédiaire diradicalaire décrit ci-dessus, qui peut couper de l'ADN mono-brin et double-brin. Il existe de nouveaux médicaments basés sur cette propriété, notamment des anticorps monoclonaux comme le mylotarg[2]. Un mécanisme diradicalaire est également proposé pour la formation de certaines biomolécules d'origine marine, les sporolides (en), qui contiennent un cholorobenzène dans leur structure. 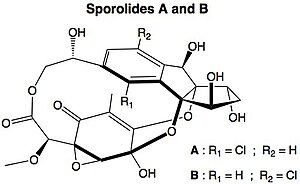 Dans ce mécanisme, un sel d'halogénure est la source de l'halogène. Une réaction modèle avec le cyclodéca-1,5-diyn-3-ène, du bromure de lithium comme source d'halogène, de l'acide acétique comme source d'hydrogène dans le DMSO à 37 °C rend cette théorie viable[3],[4] :  La réaction est de premier ordre en ènediyne avec la formation du p-benzyne A comme étape limitante. L'ion halogénure donne ensuite ses deux électrons lors de la formation de la nouvelle liaison Br-C et l'électron radicalaire transiterait via une liaison C1-C4 fugace pour former l'intermédiaire anion B. Cet anion est une base puissante capable d'arracher des protons même au DMSO pour donner le produit final. Aucune formation des composés dibromé ou dihydrogéné n'est observée. Liens externes
Notes et références
|
Portal di Ensiklopedia Dunia