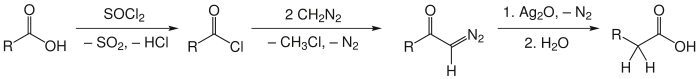|
Réaction d'Arndt-EistertLa réaction d'Arndt-Eistert ou synthèse d'Arndt-Eistert est un ensemble de réactions chimiques permettant de convertir un acide carboxylique en un homologue acide carboxylique supérieur (dont la chaine carbonée est plus longue d'un atome). Elle est considérée comme une réaction d'homologation[1],[2],[3]. Nommée d'après les chimistes allemands Fritz Arndt (1885 - 1969) et Bernd Eistert (1902 - 1978), la synthèse d'Arndt-Eistert est une méthode populaire pour produire des acides bêta-aminés à partir d'acides alpha-aminés. Dans cette réaction, l'acide carboxylique transformé en chlorure d'acyle par action du chlorure de thionyle est mis à réagir avec le diazométhane pour donner une diazocétone. En présence d'un nucléophile (eau) et d'un catalyseur métallique (Ag2O), la diazocétone se transforme en l'acide homologue recherché[4],[5] : Mécanisme réactionnelL'étape clé de cette synthèse est le réarrangement de Wolff catalysé par un métal de la diazocétone pour former un cétène[6]. Le mécanisme ci dessous décrit l'homologation d'insertion de la (S)-phénylalanine (acide 2-amino-3-phénylpropanoïque) t-BOC protégée dans laquelle l'acide (S)-3-amino-4-phénylbutanoïque t-BOC protégé est formé[5] : Le réarrangement de Wolff[7],[8] de l'intermédiaire α-diazocétone forme un cétène qui est par la suite hydrolysé pour former l'acide carboxylique. La conséquence de ce réarrangement 1,2 est le transfert du groupe méthylène du réactif diazométhane en α du groupe carboxyle. Il a été démontré que ce réarrangement préserve la stéréochimie du centre chiral car le produit formé à partir de la (S)-phénylalanine conserve sa stéréochimie (S) avec un excès énantiomérique d'au moins 99 %[5]. La chaleur, la lumière, les sels de platine, d'argent et de cuivre peuvent aussi catalyser le réarrangement de Wolff pour produire l'acide homologue désiré. RemarquesSi la synthèse d'Arndt-Eistert « classique » utilise le chlorure de thionyle pour convertir l'acide de départ en chlorure d'acyle, il est possible d'utiliser n'importe quelle procédure pour générer un chlorure d'acyle. Cette réaction génère typiquement un intermédiaire diazocétone, mais d'autre méthodes, comme le transfert d'un groupe diazo[9]. Comme le diazométhane est toxique et violemment explosif, de nombreuses autres possibilités plus sûres ont été développées[10], comme l'utilisation d'ynolates (homologation d'ester de Kowalski)[11] ou de triméthylsilyldiazométhane[12],[13]. VariantesDans la modification de Newman-Beal, l'addition de triéthylamine à la solution de diazométhane empêche la formation de produits secondaires α-chlorométhylcétone[14]. Notes et références
Voir aussi |