|
Oléfination de JuliaL'oléfination de Julia (ou oléfination de Julia-Lythgoe), qui tient son nom de Marc Julia[1], est une réaction permettant d'obtenir un alcène (3) à partir de l'attaque d'une phénylsulfone (1) sur un aldéhyde ou une cétone, suivie d'une fonctionnalisation d'un alcool et d'une élimination réductrice à l'aide d'un amalgame de sodium[2],[3] ou d'iodure de samarium(II)[1]. 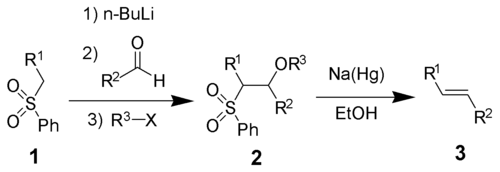 Cette réaction favorise fortement la formation d'alcène trans. Mécanisme réactionnelAprès déprotonation, l'anion phénylsulfone (2) attaque l'aldéhyde pour former l'alcoolate 3. Celui-ci est fonctionnalisé avec R3X pour donner l'intermédiaire stable 4. Le mécanisme exact de la réduction par l'amalgame de sodium n'est pas connu mais il a été démontré qu'il passait par un radical vinylique (5)[1]. La protonation du radical vinylique donne le produit attendu (6). 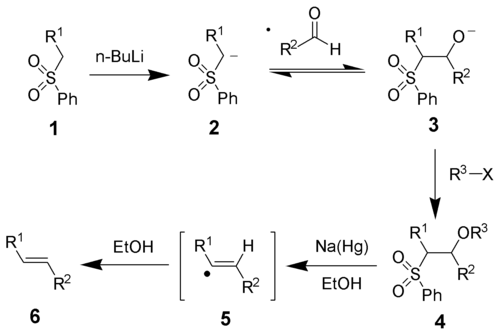 La stéréochimie de l'alcène obtenu est indépendante de la stéréochimie de la sulfone intermédiaire 4. Il est concevable que l'intermédiaire radicalaire soit en équilibre et que le produit le plus stable thermodynamiquement soit obtenu. Références
BibliographiePlusieurs revues ont été publiées sur le sujet :
|
Portal di Ensiklopedia Dunia