|
DermatophytoseDermatophytose
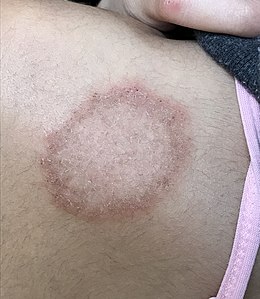
Dermatophytose de type épidermophytie sur une épaule
(à ne pas confondre avec l'érythème migrant de la maladie de Lyme).
Les dermatophytoses (ou dermatophyties ou dermatomycoses) sont des mycoses (infections de la peau ou des phanères dues à des champignons microscopiques filamenteux : les dermatophytes qui appartiennent à 3 genres, Trichophyton, Microsporum et Epidermophyton)[1]. La teigne en est l'une des nombreuses formes. Au début du XXIe siècle Trichophyton rubrum est le premier responsable de mycoses à dermatophytes dans le monde[2]. Ces champignons sont « kératinophiles », c'est-à-dire qu'ils se nourrissent de la kératine qui est la protéine fibreuse constituant la couche cornée de la peau, des poils (cheveux chez l'Homme) et des ongles (ou griffes chez l'animal). Ce sont toujours des pathogènes (ils sont absents de la flore commensale permanente ou transitoire de la peau). Les dermatophytes attaquent la peau et des phanères mais respectent toujours les muqueuses alors que les levures (Candida albicans le plus souvent) provoquent des candidoses pouvant indifféremment affecter la peau et les muqueuses[2]. Ecoépidémiologie Les dermatophytoses sont souvent zoonotiques et pourraient être confrontées à des phénomènes d'antibiorésistance, ce qui, dans le contexte d'une mondialisation des transports, invite à développer la veille épidémiologique et des approches de type One health associant à la fois des stratégies vétérinaires et de médecine humaine, notamment car les chats, chiens et rongeurs (commensaux de l'Homme) sont des porteurs fréquents de spores. Au début du XXIe siècle, les spécialistes jugent « alarmant » le nombre croissant de cas d'onychomycose chez les enfants (le plus souvent dus à T. rubrum)[2]. Des cas dus aux dermatophytes anthropophiles T. violaceum, T. tonsurans semblent aussi en développement notamment dans certains clubs de sports où les microtraumatismes de la peau (sur les tatamis ou autres substrats par exemple) pourraient contribuer à diffuser les infections (“tinea gladiatorum capitis et corporis”)[2]. M. audouinii (en) cause encore de petites épidémies de teignes (tinea corporis, tinea capitis) dans les écoles et jardins d'enfants[2]. Il a été constaté que les zébus Gudali résistent aux dermatophytoses qui touchent d'autres bovins élevés dans la même région, mais cette résistance n'a pas encore fait l'objet de recherche. Chez l'être humainUne étude récente a montré que la transmission interhumaine de dermatophytes (avec parfois des infections multiples) est courante - au sein du foyer domestique notamment - pour les mycoses du pied (tinea pedis) et de l'ongle (onychomycose) et que T. rubrum a une tendance plus élevée à la propagation avec un risque de contagion plus ou moins élevé selon les souches ; dans les cas de tinea pedis et d'onychomycose, une association avec la desquamation plantaire et une décoloration de la plaque unguéale a été montrée[2]. Formes cliniquesTeignesLes teignes sont des lésions du cuir chevelu et des cheveux ou de la peau.
Épidermophyties Les principales épidermophyties sont :
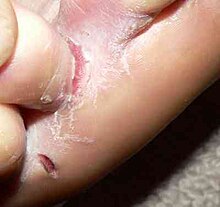
Atteintes unguéalesL'onychomycose est une lésion qui débute par une atteinte du bord libre de l'ongle, par une tache jaunâtre/ocre, d'extension lente. Elle commence habituellement par le bord latéral de l'ongle, puis donne ce que l'on appelle des fusées dermatophytiques (sorte de flèches allant du bord libre vers la matrice). Une fois la tablette unguéale entièrement atteinte, le stade final est l'onychodystrophie totale. Les onychomycoses n'évoluent jamais vers la guérison spontanée. DermatophytiesCe sont des manifestations allergiques à distance du foyer infectieux. L'aspect est celui d'une dyshidrose, mais peut aussi ressembler à un herpès circiné, bien que l'on ne retrouve aucun dermatophyte à cet endroit (lésion appelé aussi mycétide). DiagnosticLe diagnostic et le traitement doivent être précis pour éviter des surcoûts et du temps perdu. En cas de suspicion de mycose, le prélèvement doit être systématique pour éliminer les diagnostics différentiels fréquents : traumatiques (beaucoup d'ongles de pied peuvent ressembler à s'y méprendre à une mycose et sont pourtant dus à des conflits avec le chaussant, l'avis d'un pédicure-podologue peut préciser ce diagnostic), psoriasis, problèmes vasculaires (en cas d'artérite, les ongles sont moins bien vascularisés et peuvent se décoller)… Le prélèvement mycologique doit être effectué par du personnel qualifié (biologiste, technicien de laboratoire). Un bon prélèvement permettra un traitement efficace. Le prélèvement doit être réalisé à distance de tout traitement antifongique (le traitement, s'il a été commencé doit avoir été arrêté au minimum 1 à 2 mois avant le prélèvement). Pour une atteinte cutanée, le biologiste doit gratter les squames afin de les analyser (examen direct et culture). Pour une atteinte des ongles, le biologiste doit prélever à la limite de l'ongle sain, en effet, c'est à cet endroit uniquement que le champignon pourra être trouvé. Le résultat est délivré 3 à 5 semaines après prélèvement. Le diagnostic se fait après prélèvement(s), examen microscopique et cultures. Traitement
Les principales substances ensuite utilisées sont :
HistoireLes dermatophytoses sont présentes depuis avant 1906, époque à laquelle la teigne était traitée avec des composés de mercure ou parfois de soufre ou d'iode. Les zones poilues étant considérées comme trop difficiles à traiter, le cuir chevelu était traité aux rayons X et suivi d'un médicament antifongique[9]. Un autre traitement datant de la même époque était l'application de poudre d'Araroba (en)[10]. Autres animauxLa teigne causée par Trichophyton verrucosum (en) est une affection clinique fréquente chez les bovins. Les jeunes animaux sont plus fréquemment touchés. Les lésions sont localisées sur la tête, le cou, la queue et le périnée[11]. La lésion typique est une croûte ronde et blanchâtre. Des lésions multiples peuvent fusionner et prendre l'aspect d'une carte.
La dermatophytose est également diagnostiquée chez les moutons, les chiens, les chats et les chevaux. Les agents responsables, outre Trichophyton verrucosum, sont T. mentagrophytes, T. equinum, Microsporum gypseum, M. canis et M. nanum[12]. La dermatophytose peut également être présente dans l'holotype du mammifère eutriconodonte crétacé Spinolestes (en), ce qui suggère une origine mésozoïque pour cette maladie. DiagnosticLa teigne chez les animaux de compagnie peut souvent être asymptomatique, ce qui entraîne un état de porteur qui infecte d'autres animaux de compagnie. Dans certains cas, la maladie n'apparaît que lorsque l'animal développe une immunodéficience. Des taches circulaires nues sur la peau suggèrent le diagnostic, mais aucune lésion n'est vraiment spécifique au champignon. Des plaques similaires peuvent résulter d'allergies, de la gale sarcoptique et d'autres affections. Trois espèces de champignons sont à l'origine de 95 % des dermatophytoses chez les animaux de compagnie[réf. nécessaire] : Microsporum canis, Microsporum gypseum et Trichophyton mentagrophytes. Les vétérinaires disposent de plusieurs tests pour identifier la teigne et les espèces fongiques qui en sont responsables : Le test de Woods : Il s'agit d'une lumière ultraviolette avec une lentille grossissante. Seuls 50 % des M. canis apparaissent sous forme de fluorescence vert pomme sur les tiges des poils, sous la lumière UV. Les autres champignons n'apparaissent pas. La matière fluorescente n'est pas le champignon lui-même (qui n'est pas fluorescent), mais plutôt un produit d'excrétion du champignon qui adhère aux poils. La peau infectée n'est pas fluorescente. Test microscopique : Le vétérinaire prélève des poils autour de la zone infectée et les place dans une solution de coloration pour les examiner au microscope. Les spores fongiques peuvent être observées directement sur les tiges des poils. Cette technique permet d'identifier une infection fongique dans environ 40 à 70 % des cas, mais ne permet pas d'identifier l'espèce de dermatophyte. Test de culture : C'est le moyen le plus efficace, mais aussi le plus long, de déterminer si la teigne est présente chez un animal de compagnie. Dans ce test, le vétérinaire prélève des poils de l'animal ou des spores fongiques dans les poils de l'animal à l'aide d'une brosse à dents ou d'un autre instrument, et inocule un milieu fongique pour la culture. Ces cultures peuvent être brossées avec du ruban adhésif transparent, puis lues par le vétérinaire à l'aide d'un microscope, ou être envoyées à un laboratoire de pathologie. Les trois types de champignons communément à l'origine de la teigne des animaux de compagnie peuvent être identifiés par leurs spores caractéristiques. Il s'agit de macroconidies d'apparence différente pour les deux espèces communes de Microspora, et de microconidies typiques pour les infections à Trichophyton[12]. L'identification des espèces de champignons impliquées dans les infections des animaux de compagnie peut être utile pour contrôler la source de l'infection. M. canis, malgré son nom, se rencontre plus fréquemment chez les chats domestiques, et 98 % des infections de chats sont dues à cet organisme[réf. nécessaire], mais il peut également infecter les chiens et les humains. T. mentagrophytes a un réservoir majeur chez les rongeurs, mais peut également infecter les lapins de compagnie, les chiens et les chevaux. M. gypseum est un organisme du sol et est souvent contracté dans les jardins et autres lieux de ce type. Outre l'homme, il peut infecter les rongeurs, les chiens, les chats, les chevaux, les bovins et les porcs[13]. TraitementAnimaux de compagnieLe traitement nécessite à la fois un traitement oral systémique avec la plupart des médicaments utilisés chez l'homme - la terbinafine, le fluconazole ou l'itraconazole - et un traitement topique par trempage[14]. Les poils des animaux de compagnie étant généralement plus longs que ceux des humains, la zone infectée et éventuellement tous les poils longs de l'animal doivent être coupés afin de réduire la charge de spores fongiques qui s'accrochent aux poils de l'animal. Toutefois, il n'est généralement pas nécessaire de raser de près, car les entailles dans la peau favorisent l'aggravation de l'infection cutanée. Un bain bihebdomadaire de l'animal avec une solution diluée de chaux et de soufre est efficace pour éradiquer les spores fongiques. Ce traitement doit être poursuivi pendant 3 à 8 semaines[15]. Le lavage des surfaces dures de la maison avec une solution d'eau de Javel à base d'hypochlorite de sodium 1:10 est efficace pour tuer les spores, mais il est trop irritant pour être utilisé directement sur les poils et la peau. Les poils d'animaux domestiques doivent être rigoureusement enlevés de toutes les surfaces de la maison, puis le sac de l'aspirateur, voire l'aspirateur lui-même, doit être jeté lorsque cela a été fait à plusieurs reprises. Il est important d'éliminer tous les poils, car les spores peuvent survivre 12 mois, voire deux ans, sur les poils qui s'accrochent aux surfaces[16]. BétailChez les bovins, une infestation est difficile à guérir, car le traitement systémique n'est pas rentable. Le traitement local à l'aide de composés iodés prend du temps, car il nécessite le grattage des lésions croûteuses. En outre, il doit être effectué avec précaution et à l'aide de gants, pour éviter que le travailleur ne soit infesté. Notes et références
Voir aussiArticles connexes
Liens externes
Bibliographie
|