|
Coloration de Ziehl-NeelsenLa coloration de Ziehl-Neelsen (coloration ZN) est une technique de coloration microbiologique inventée à la fin du XIXe siècle pour visualiser les Mycobactéries au microscope optique. Elle repose sur le fait que les Mycobactéries sont des bacilles acido-alcoolorésistants (BAAR) à la paroi épaisse et cireuse : une coloration énergique à chaud franchit cette paroi et colore aussi toutes les autres bactéries éventuellement présentes, puis une décoloration avec un mélange d'acide et d'alcool décolore toutes les bactéries sauf les Mycobactéries, et enfin une contre-coloration permet de visualiser les éléments décolorés à l'étape précédente. HistoireLorsque Robert Koch annonce officiellement la découverte du bacille qui portera son nom, le 24 mars 1882, il décrit une méthode de coloration qui contient déjà les trois éléments nécessaires à la visualisation des BAAR : l'emploi d'un mordant (il utilise de l'hydroxyde de potassium), l'exposition à la chaleur pour accélérer la coloration primaire, et une contre-coloration (du brun Bismarck) qui n'affecte pas les Mycobactéries[1],[2]. Paul Ehrlich, ami et admirateur de Koch, apporte rapidement d'importantes améliorations au processus : il emploie comme mordant une solution aqueuse saturée d'aniline, introduit l'usage de la fuchsine ou du violet de méthylène comme colorant primaire, et décrit pour la première fois l'étape de décoloration différentielle par un acide fort (il utilise de l'acide nitrique dilué au tiers) qui épargne les Mycobactéries[2],[3]. Il est aussi le premier à décrire la fixation à la chaleur par passage direct de la lame dans la flamme d'un bec Bunsen. Deux médecins allemands vont faire évoluer la technique jusqu'à sa forme actuelle. Franz Ziehl, confronté à une difficulté d'approvisionnement en aniline suffisamment pure pour répliquer le protocole d'Ehrlich, choisit comme mordant le phénol mais n'emploie pas la fuchsine[2],[4]. L'année suivante Friedrich Neelsen combine les deux innovations précédentes, la fuchsine comme colorant primaire et le phénol comme mordant (« carbol-fuchsine » de Ziehl-Neelsen, du nom d'« acide carbolique » donné au phénol à cette époque), et utilise de l'acide sulfurique dilué au tiers comme décolorant[2],[5]. Réalisation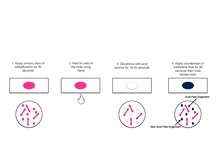  Les solutions utilisées pour la coloration peuvent être préparées de la manière suivante[6] :
Les étapes de la coloration sont les suivantes[6] :
VariantesIl existe une controverse portant sur la concentration en fuchsine (et accessoirement, en phénol) à utiliser pour le diagnostic médical. Alors qu'un référentiel de l'OMS datant de 1998 recommande une solution à 0,3% pour l'usage diagnostique[7], certains auteurs ont attiré l'attention sur une possible inefficacité de la fuchsine à cette concentration : par rapport à la solution à 1% décrite initialement par Neelsen, une solution de fuchsine plus diluée serait à l'origine d'une perte de sensibilité potentiellement responsable d'erreurs diagnostiques par défaut (faux négatifs)[8]. La méthodologie de cette étude a été critiquée car elle n'a pas pris en compte des variations de la concentration en phénol, ce qui en ferait un possible facteur confondant[9]. Une étude de 2005 n'a pas retrouvé de supériorité de la fuchsine à 1% par rapport à la fuchsine à 0,3% à moins de multiplier par trois la durée d'exposition (15 min vs. 5 min)[10]. Par la suite, en 2007, un groupe d'auteurs s'est positionné en faveur de l'emploi d'une solution de fuchsine à 1% avec un temps d'exposition supérieur ou égal à 10 minutes[11]. Le nouveau référentiel de l'OMS pour le diagnostic microscopique de la tuberculose pulmonaire, paru en 2013, préconise d'utiliser une solution de fuchsine à 1%[12]. En 2011 une étude multicentrique impliquant 158 laboratoires a comparé sur plus de 700 000 lames la performance diagnostique de la coloration ZN en fonction du mélange décolorant employé : solution aqueuse d'acide sulfurique à 25% vs. solution aqueuse d'acide chlorhydrique à 3%, 6% ou 10%[13]. Les auteurs concluent que l'acide chlorhydrique à 6-10% donne les meilleurs résultats (sans différence significative entre les deux concentrations), la concentration de 3% étant inférieure en termes de sensibilité tandis que l'acide sulfurique donne un plus grand nombre de faux positifs. Domaine d'application, performances et limitationsSi la coloration de Ziehl-Neelsen est conçue pour permettre le diagnostic de la tuberculose au microscope optique, le caractère acido-alcoolorésistant qu'elle met en évidence n'est pas l'apanage de Mycobacterium tuberculosis : Par ailleurs il est bien établi que des bacilles tuberculeux peuvent perdre leur acido-alcoolorésistance lorsqu'ils entrent en quiescence à l'intérieur de corps de l'hôte : ce phénomène, que l'on nommera plus tard le « paradoxe de Koch », est décrit dès 1883 par L.C. Malassez et W. Vignal dans une série de notes à la Société de biologie[14],[15],[16] puis dans un mémoire[17]. Ses déterminants biochimiques, qui ne sont pas complètement élucidés, font intervenir des modifications dans les dernières étapes de biosynthèse des acides mycoliques ainsi qu'un accroissement du nombre de certaines inclusions cytoplasmiques à contenu lipidique[18]. Techniques alternativesLes autres techniques de coloration employées pour l'observation microscopique des Mycobactéries se divisent en deux catégories :
Les méthodes de biologie moléculaire sont de plus en plus utilisées dans les pays développés car elles sont rapides, spécifiques, et peuvent permettre – outre l'identification proprement dite – de mettre en évidence la résistance aux antituberculeux bien plus rapidement que les méthodes phénotypiques traditionnelles[19]. Dans les PED, où la tuberculose est endémique et où elles seraient le plus nécessaires, l'accès à ces méthodes est encore limité par leur coût et par l'environnement technique qu'elle nécessitent : c'est pourquoi la microscopie, facile à mettre en œuvre et peu coûteuse, reste la technique diagnostique de référence dans ces contextes[20]. Notes et références
|