|
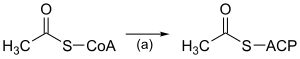
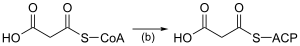
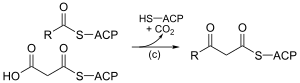
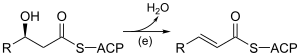
Biosynthèse des acides grasLa biosynthèse des acides gras est une voie métabolique essentielle du processus de lipogenèse chez les eucaryotes et les bactéries. Elle réalise la biosynthèse d'acides gras par condensations de Claisen successives d'unités malonyl-CoA ou méthylmalonyl-CoA sur une amorce d'acétyl-CoA catalysées par l'acide gras synthase (FAS). Acides gras linéaires Acides gras linéaires saturésDe façon semblable à la β-oxydation, la biosynthèse des acides gras linéaires saturés met en œuvre de façon itérative les six réactions présentées dans le tableau ci-dessous, jusqu'à la production de l'acide palmitique. Le schéma ci-contre présente les réactions qui se déroulent chez les microorganismes et le tableau donne la liste des enzymes présentes chez E. coli. Ces réactions sont réalisées par un complexe enzymatique appelé acide gras synthase II (FAS II) généralement constitué de plusieurs enzymes discrètes agissant ensemble. Le complexe FAS II est présent chez les bactéries, les plantes, la plupart des mycètes, les protistes ainsi que dans les mitochondries. Chez les autres eucaryotes, les levures et certains mycètes, ces mêmes réactions sont réalisées par un dimère de grosses sous-unités protéiques identiques (homodimère) qui possèdent l'ensemble des activités enzymatiques requises pour produire des acides gras et qu'on appelle acide gras synthase I (FAS I). Cette dernière est moins efficace que la FAS II mais permet de synthétiser une plus grande variété de molécules, notamment des acides gras plus courts par terminaison anticipée du processus. Les résidus d'acide gras en cours d'assemblage sont liés par covalence à l'acyl carrier protein (ACP) en formant un thioester avec l'unité phosphopantéthéine de cette dernière[1]. Une fois qu'un acide gras linéaire saturé à 16 atomes de carbone est formé (acide palmitique), il peut subir diverses modifications, notamment sous l'action de l'acide gras synthase III (FAS III), qui utilise des molécules à deux atomes de carbone pour allonger des acides gras préformés.
L'acétyl-CoA est converti en malonyl-CoA par l'acétyl-CoA carboxylase afin d'alimenter la voie métabolique de biosynthèse des acides gras. L'acétyl-CoA carboxylase est le point de régulation de la synthèse des acides gras saturés linéaires, à la fois par phosphorylation et par allostérie, la première étant surtout le fait des mammifères tandis que la seconde intervient chez la plupart des êtres vivants. La régulation allostérique consiste en l'inhibition par le palmitoyl-CoA (rétroinhibition) et en l'activation par le citrate, cette dernière étant essentielle dans le mécanisme de stockage de l'énergie lorsque le cycle de Krebs est saturé, ce qui est précisément indiqué par l'augmentation de la concentration en citrate. Chez l'homme, les acides gras sont synthétisés essentiellement dans le foie et les glandes mammaires en lactation ainsi que, dans une moindre mesure, dans le tissu adipeux. L'essentiel de l'acétyl-CoA est formé à partir du pyruvate par le complexe pyruvate déshydrogénase des mitochondries. L'acétyl-CoA produit dans les mitochondries est condensé avec l'oxaloacétate par la citrate synthase pour donner du citrate, transporté à travers la membrane mitochonriale dans le cytosol, où il est clivé en acétyl-CoA et oxaloacétate par l'ATP citrate lyase. L'oxaloacétate cytosolique est réduit en malate par la malate déshydrogénase cytoplasmique et le malate est renvoyé dans les mitochondries pour prendre part au cycle de Krebs[2]. Acides gras linéaires insaturésLa désaturation des acides gras requiert de l'oxygène O2, du NADH+H+ et le cytochrome b5. Cette réaction, qui se déroule dans le réticulum endoplasmique, conduit à l'oxydation à la fois de l'acide gras et du NADH. La réaction de désaturation la plus courante introduit une double liaison entre les atomes de carbone 9 et 10 par une Δ9-acide gras désaturase, mais les Humains possèdent également des Δ6, Δ5 et Δ4-désaturases. Les acides gras insaturés sont des éléments fondamentaux des membranes cellulaires chez les bactéries et les eucaryotes, où ils interviennent en premier lieu dans la régulation de la fluidité membranaire, mais jouent aussi un rôle important dans la signalisation cellulaire (signalisation lipidique) ainsi que dans la réplication de l'ADN[3].  Désaturation anaérobieDe nombreuses bactéries utilisent la voie anaérobie pour produire des acides gras insaturés. Cette voie métabolique n'utilise pas d'oxygène O2 ni d'enzyme spécifique pour insérer une double liaison avant élongation à l'aide de la machinerie habituelle de synthèse des acides gras. Ce processus a été entièrement élucidé chez E coli :
La plupart des bactéries qui réalisent la désaturation anaérobie des acides gras contiennent des homologues des protéines FabA et FabB[6]. Les Clostridia, une classe de bactéries de l'embranchement des Firmicutes, constituent la principale exception, disposant d'une enzyme particulière qui reste à identifier et qui catalyse la formation de la double liaison cis[5]. La désaturation anaérobie est soumise à une régulation transcriptionnelle par les protéines FadR et FabR. FadR a été la plus étudiée des deux et agit à la fois comme activateur de la transcription des gènes fabA et fabB et comme répresseur du régulon de la β-oxydation. En revanche, la protéine FabR agit comme répresseur de la transcription des gènes fabA et fabB[4].  Désaturation aérobieLa voie aérobie est la plus répandue pour synthétiser des acides gras insaturés. Elle est en utilisée par tous les eucaryotes ainsi que certaines bactéries. Cette voie métabolique a recours à des acides gras désaturases pour convertir des acides gras saturés en acides gras insaturés[7]. Toutes les désaturases ont besoin d'oxygène et consomment en fin de compte du NADH bien qu'il s'agisse malgré tout d'une réaction d'oxydation. Ces enzymes sont spécifiques des doubles liaisons qu'elles introduisent sur les substrats. Chez Bacillus subtilis, la désaturase Δ5-Des introduit spécifiquement une double liaison cis-Δ5 sur des acides gras saturés[3],[7] tandis que Saccharomyces cerevisiae possède une désaturase, Ole1p, qui introduit spécifiquement une double liaison cis-Δ9[3]. Chez B. subtilis, la désaturation aérobie est régulée par un système à deux composants (en) : DesK, une kinase membranaire, et DesR, un régulateur transcriptionnel des gènes Des[3],[7]. Cette régulation est sensible à la température, le gène étant davantage exprimé lorsque la température diminue. Les acides gras insaturés augmentent la fluidité des membranes cellulaires et les stabilisent aux basses températures. La kinase DesK joue le rôle de capteur thermique membranaire qui s'autophosphoryle lorsque la température baisse. Le groupe phosphate est alors transféré à la protéine DesR qui est à son tour phosphorylée en DesR-P. Deux protéines DesR-P dimérisent et se lient aux promoteurs des gènes Des pour recruter des ARN polymérases afin d'amorcer la transcription[3],[7]. Coexistence des deux modes de désaturationLes modes aérobie et anaérobie de désaturation des acides gras ne coexistent généralement pas, mais des bactéries telles que Pseudomonas aeruginosa[8],[9] et Vibrio ABE-1[10] constituent à cet égard une exception. Ainsi P. aeruginosa met en œuvre une désaturation essentiellement anaérobie, mais possède parallèlement deux voies de désaturation aérobie : la première utilise une Δ9-désaturase (DesA) qui catalyse la formation d'une double liaison sur les lipides membranaires ; la seconde utilise deux protéines, DesC et DesB, qui agissent ensemble comme une Δ9-désaturase pour insérer une double liaison sur un résidu d'acide gras saturé lié à une coenzyme A. Cette seconde voie est régulée par le répresseur DesT, qui réprime également l'expression du gène fabAB de la désaturation anaérobie en présence d'acides gras insaturés exogènes. Ce mécanisme permet de coordonner l'expression de ces deux voies métaboliques chez cette bactérie[9],[11]. Acides gras ramifiésLes acides gras ramifiés des membranes biologiques sont souvent des acides gras saturés de structure dite ou bien iso ou bien antéiso selon que la ramification est branchée respectivement sur le deuxième ou sur le troisième atome de carbone en partant de l'extrémité –CH3 de la chaîne hydrocarbonée de l'acide gras. Il existe plusieurs mécanismes de biosynthèse des acides gras ramifiés, selon que l'amorce utilisée est un α-cétoacide ou un ester d'acyl-CoA[12]. Les bactéries de l'ordre des Actinomycetales possèdent quant à elles des mécanismes particuliers de biosynthèse des acides gras ramifiés, dont l'acide tuberculostéarique. À partir d'α-cétoacides comme amorcesAmorce valine, donnant de l'isobutyryl-CoA et aboutissant à des acides gras de structure iso à nombre pair d'atomes de carbone. Amorce leucine, donnant de la 3-méthylbutyryl-CoA et aboutissant à des acides gras de structure iso à nombre impair d'atomes de carbone. Amorce isoleucine, donnant de la 2-méthylbutyryl-CoA et aboutissant à des acides gras de structure antéiso à nombre impair d'atomes de carbone. Biosynthèse de différents types d'acides gras ramifiés en fonction des amorces utilisées. Les α-cétoacides intervenant comme amorces dérivent de la transamination et de la décarboxylation de la valine, de la leucine et de l'isoleucine pour donner respectivement de l'isobutyryl-CoA, de la 3-méthylbutyryl-CoA, et de la 2-méthylbutyryl-CoA[13]. La première amorce, issue de la valine, donne des acides gras de structure iso à nombre pair d'atomes de carbone tels que l'acide 14-méthylpentadécanoïque (isopalmitique) tandis que la deuxième, issue de la leucine, peut donner des acides gras de structure iso à nombre impair d'atomes de carbone tels que l'acide 13-méthyltétradécanoïque, et que la troisième, issue de l'isoleucine, conduit aux acides gras de structure antéiso à nombre impair d'atomes de carbone tels que l'acide 12-méthyltétradécanoïque[14]. Les précurseurs des amorces sont décarboxylés par une 2-oxoacide ramifié décarboxylase, ou BCKA décarboxylase. E. coli utilise ensuite le même mécanisme de synthèse par condensations de Claisen d'unités malonyl-CoA que pour les acides gras linéaires[15]. Les produits finaux sont essentiellement des acides gras ramifiés de 12 à 17 atomes de carbone dont la composition tend à être uniforme et caractéristique pour de nombreuses espèces de bactéries[14]. BCKA décarboxylaseLa 2-oxoacide ramifié décarboxylase, ou BCKA décarboxylase, est une enzyme composée de deux sous-unités en configuration tétramérique (A2B2) indispensable pour la biosynthèse des acides gras ramifiés. Elle est responsable de la décarboxylation des α-cétoacides résultant de la transamination de la valine, de la leucine et de l'isoleucine, et produit les amorces utilisées pour la synthèse des acides gras ramifiés. Cette enzyme est sensiblement plus active avec les α-cétoacides ramifiés qu'avec les substrats à chaîne droite, et, chez les espèces du genre Bacillus, elle présente une affinité maximum pour l'α-céto-β-méthylvalérate (issu de l'isoleucine), suivi de l'α-cétoisocaproate et de l'α-cétoisovalérate[14],[15]. Modulation de la longueur et de la structure des acides gras ramifiésLes acides gras ramifiés synthétises à partir de ces amorces comptent généralement de 12 à 17 atomes de carbone. La proportion de ces différentes molécules tend à demeurer constante et uniforme au sein d'une espèce de bactéries donnée, mais est susceptible de modulations en fonction de variations de la concentration en malonyl-CoA, de la température ou des facteurs thermostables (HST). Les HST agissent notamment sur l'affinité relative de la BCKA décarboxylase envers les différents substrats α-cétoacides, ce qui a pour effet de modifier les rapports entre les quantités des différents acides gras ramifiés produits[14]. Par ailleurs, l'augmentation de la concentration en malonyl-CoA a pour effet d'augmenter la proportion d'acides gras en C17 jusqu'à la concentration optimale de malonyl-CoA d'environ 20 µmol·L-1. La baisse de la température tend également à déplacer la production des acides gras ramifiés vers les molécules en C17 chez les espèces du genre Bacillus[12],[14]. À partir d'acides carboxyliques ramifiés à chaîne courte La biosynthèse des acides gras ramifiés à partir d'acides carboxyliques ramifiés à chaîne courte, tels que l'acide isovalérique, l'acide isobutyrique ou encore l'acide 2-méthylbutyrique, est semblable à celle utilisant des α-cétoacides comme amorces. Ce mécanisme est mis en œuvre le plus souvent chez les bactéries qui ne sont pas en mesure d'utiliser ces derniers. Les acides carboxyliques nécessaires à ces amorces sont généralement pris dans l'environnement, comme cela s'observe chez les bactéries de la panse des ruminants[16]. La réaction globale de biosynthèse de l'acide isopalmitique à partir de l'isobutyryl-CoA est par exemple[12] :
Acide tuberculostéariqueL'acide tuberculostéarique, ou acide 10-méthylstéarique, est un acide gras saturé synthétisé par les espèces de bactéries du genre Mycobacterium et par deux espèces du genre Streptomyces. Il est produit à partir d'un acide gras monoinsaturé, l'acide oléique. Après estérification de ce dernier sur un phospholipide, la S-adénosylméthionine donne un groupe méthyle sur la double liaison de cet acide gras[17]. Cette méthylation donne l'intermédiaire 10-méthylèneoctadécanoyle, qui est ensuite réduit avec du NADPH pour donner de l'acide 10-méthylstéarique, c'est-à-dire de l'acide tuberculostéarique[13]. Acides gras oméga-alicycliques Les acides gras oméga-alicycliques sont des acides gras dont la chaîne hydrocarbonée est terminée par un cycle aliphatique. La membrane plasmique de certaines bactéries est constituée en grande partie d'acide gras oméga-alicycliques. Ces derniers sont produits par le même système enzymatique que celui qui produit les acides gras ramifiés à partir d'acides carboxyliques à chaîne courte, la différence provenant de l'alimentation du système en thioesters de la coenzyme A et d'acides carboxyliques cycliques[12]. La production des amorces cyclique n'est pas encore bien comprise mais il a été proposé qu'elle implique la conversion d'oses en acide shikimique, ce dernier étant à son tour converti en thioester de la coenzyme A et d'acide cyclohexylcarboxylique, utilisé comme amorce[16]. Notes et références
|