|
Alternance de générations L'alternance de générations (appelée aussi métagenèse) est une caractéristique du cycle de vie des plantes (prises ici au sens d'Archaeplastida). Une génération est un stade de développement multicellulaire issu d’un stade cellulaire (spore ou gamète) et produisant un stade cellulaire (gamète ou spore). La génération produisant des gamètes est le gamétophyte, et la génération produisant des spores est le sporophyte. De façon générale, un gamétophyte alterne avec un sporophyte. À maturité, le sporophyte produit des spores. Les spores germent et se développent sous forme d'un gamétophyte. À maturité, le gamétophyte produit des gamètes par mitose, sans modification du nombre de chromosomes. Deux gamètes (provenant de deux organismes différents de la même espèce ou du même organisme) fusionnent pour produire un zygote, qui se développe sous la forme d'un sporophyte. Ce cycle, de gamétophyte à gamétophyte (ou bien de sporophyte à sporophyte), est la manière dont toutes les plantes terrestres et beaucoup d'algues pratiquent la reproduction sexuée. Parce qu'elle constitue une étape clé dans l'alternance des générations, il est probable que la méiose, processus qui permet de réduire de moitié le nombre de chromosomes, de 2n à n, ait une fonction adaptative fondamentale. La nature de cette fonction est encore en débat, mais les deux idées principales sont que la méiose est adaptative parce qu'elle facilite la réparation des altérations qui peuvent affecter l'ADN ou parce qu'elle provoque des variations génétiques. Selon la place de la méiose dans le cycle, le sporophyte peut être haploïde ou diploïde, de même que le gamétophyte. Les places de la méiose et de la fécondation dans le cycle définissent les phases du cycle et l’alternance des phases (haploïde et diploïde, voire dicaryotique lorsque la fusion des noyaux est déplacée dans le temps par rapport à la fusion des cytoplasmes lors de la fécondation). L’alternance cytologique des phases est indépendante de l’alternance morphologique des générations. La relation entre le sporophyte et le gamétophyte varie selon les différents groupes de plantes. Chez les algues qui ont une alternance de générations, le sporophyte et le gamétophyte sont des organismes séparés indépendants, qui peuvent éventuellement avoir une apparence similaire. Chez les hépatiques, les mousses et les anthocérotes, le sporophyte est bien moins développé que le gamétophyte et est largement dépendant de ce dernier. Bien que les sporophytes des mousses et anthocérotes puissent assurer la photosynthèse, ils ont besoin de photosynthats[1] supplémentaires provenant du gamétophyte pour soutenir leur croissance et le développement des spores, et en dépendent pour la fourniture d'eau, de nutriments minéraux et d'azote[2],[3]. Par contre, chez toutes les plantes vasculaires modernes, le gamétophyte est bien moins développé que le sporophyte, bien que leurs ancêtres du Dévonien eussent des gamétophytes et des sporophytes de complexité à peu près équivalente[4]. Chez les fougères, le gamétophyte est un petit prothalle autotrophe en forme de lame dont le jeune sporophyte est brièvement dépendant pour son alimentation. Chez les plantes à fleurs, la réduction du gamétophyte est extrême : il se compose de seulement quelques cellules qui se développent à l'intérieur du sporophyte. Tous les animaux se développent différemment. Un animal adulte est diploïde et est donc, en un sens, l'équivalent d'un sporophyte. Toutefois, un animal produit « directement » des gamètes haploïdes par méiose. Il n'y a pas de spores haploïdes capables de se diviser, si bien qu'il n'y a pas d'équivalent d'un gamétophyte haploïde. Il n'y a pas d'alternance entre des formes diploïde et haploïde. D'autres organismes, tels que les champignons, peuvent avoir des cycles de vie dans lesquels les différents types d'organismes alternent et donc le terme d'« alternance de générations » s'applique aussi à eux. Les cycles biologiques des plantes et des algues avec alternance de phases multicellulaires haploïdes et diploïdes sont dits « diplohaplontiques » (les termes équivalents « haplodiplontiques » ou « dibiontiques » sont également usités). Les cycles biologiques, tels que ceux des animaux, dans lesquels il n'y a qu'un seul stade multicellulaire diploïde sont appelés « diplontiques » ; les cycles biologiques dans lesquels il n'y a qu'un seul stade haploïde multicellulaire sont dits « haplontiques ». DéfinitionDans l'exposé de « l'alternance de générations » ci-dessus, on considère que l'alternance d'une forme diploïde multicellulaire avec une forme haploïde multicellulaire est la caractéristique déterminante, indépendamment du fait que ces formes soient des organismes indépendants ou non[5]. Chez certaines espèces, telles que l'algue Ulva lactuca, les formes diploïdes et haploïdes sont en effet des organismes vivants indépendants, d'apparence pratiquement identique, que l'on qualifie donc d'isomorphes. Les gamètes haploïdes, nageant librement, forment un zygote diploïde qui germe pour produire un sporophyte diploïde multicellulaire. Le sporophyte produit par méiose des spores haploïdes, nageant librement, qui germent pour produire des gamétophytes haploïdes. Cependant, chez certains autres groupes, le sporophyte ou le gamétophyte peuvent être fortement réduits et incapables de vivre librement. Par exemple, chez tous les bryophytes, la génération du gamétophyte est dominante et le sporophyte est dépendant du gamétophyte. En revanche, chez toutes les plantes vasculaires terrestres modernes, les gamétophytes sont fortement réduits, bien que des témoins fossiles indiquent qu'elles dérivent d'ancêtres isomorphes[4]. Chez les plantes à graines, le gamétophyte femelle se développe totalement dans le sporophyte qui le protège et le nourrit ainsi que l'embryon du sporophyte qu'il produit. Les grains de pollen, qui sont les gamétophytes mâles, sont réduits à quelques cellules (trois cellules seulement dans de nombreux cas). Dans ce cas, la notion de deux générations est moins évidente ; selon Bateman & Dimichele, « [s]porophyte et gamétophyte fonctionnent en réalité comme un organisme unique »[6]. L'expression « alternance de phases » serait alors plus appropriée[7]. HistoireLes débats sur l'alternance de générations au début du XXe siècle peuvent être source de confusion parce que plusieurs manières de classer les « générations » coexistaient (sexuée/asexuée, gamétophyte/sporophyte, haploïde/diploïde, etc.)[8]. Initialement, alors qu'ils étudiaient le développement des tuniciers, cnidaires et trématodes, Adelbert von Chamisso et Japetus Steenstrup ont décrit la succession des générations organisées différemment (sexuée et asexuée) chez les animaux sous le nom d'« alternance de générations »[8]. Ce phénomène est également connu sous le nom d'hétérogamie. Actuellement, l'expression « alternance de générations » est presque exclusivement associée aux cycles biologiques des plantes, en particulier avec l'alternance de gamétophytes et de sporophytes[8]. Wilhelm Hofmeister a démontré l'alternance morphologique de générations chez les plantes[9], entre une génération sporifère (sporophyte) et une génération porteuse de gamètes (gamétophyte)[10],[11]. À cette époque, a émergé un débat centré sur l'origine de la génération asexuée des plantes terrestres (c'est-à-dire le sporophyte), et classiquement caractérisé comme un conflit entre les théories de l'alternance de générations antithétique (Čelakovský, 1874) et homologue (Pringsheim, 1876)[8]. C'est Čelakovský qui a forgé les termes « sporophyte » et « gamétophyte ». Eduard Strasburger (1874) a découvert l'alternance entre phases nucléaires diploïdes et haploïdes[8], appelée également « alternance cytologique de phases nucléaires »[12]. Bien qu'elles coïncident le plus souvent, l'alternance morphologique et l'alternance des phases nucléaires sont parfois indépendantes l'une de l'autre, par exemple, chez de nombreuses algues rouges, la même phase nucléaire peut correspondre à deux générations morphologiques différentes[12]. Chez certaines fougères qui ont perdu la reproduction sexuée, il n'y a aucun changement de phase nucléaire, mais l'alternance de générations est maintenue[13].
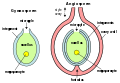
Alternance de générations chez les plantesÉléments fondamentauxLe diagramme ci-dessus montre les éléments fondamentaux de l'alternance de générations chez les plantes (il existe toutefois de nombreuses variantes chez les différents groupes de plantes). En partant de la droite du diagramme, les processus impliqués sont les suivants[14] :
L'« alternance de générations » dans le cycle biologique est donc l'alternance entre une génération de sporophytes diploïdes (2n) et une génération de gamétophytes haploïdes (n).  La situation est tout à fait différente de celle des animaux, chez lesquels le processus fondamental est qu'un individu diploïde (2n) produit « directement » des gamètes haploïdes (n) par la méiose. Les spores (c'est-à-dire des cellules haploïdes capables de subir la mitose) ne sont pas produites, de sorte qu'il n'existe aucun organisme multicellulaire haploïde. Les gamètes unicellulaires sont les seules entités haploïdes. Hypothèses de mise en place de l'alternance des générationsDeux hypothèses expliquent cette mise en place : la théorie de « l'intercalation » suppose que la méiose est retardée dans le cycle de développement. Une nouvelle génération diploïde s'intercale dans un cycle monogénétique haploïde ; la théorie de « la transformation » envisage que la génération sporophytique résulte de la transformation du gamétophyte qui est la génération originelle[15]. VariationsLe diagramme présenté plus haut est une bonne représentation du cycle biologique de certaines algues multicellulaires (par exemple le genre Cladophora) qui ont des sporophytes et des gamétophytes d'apparence presque identique et qui n'ont pas des types différents de spores ou de gamètes[16]. Cependant, il existe beaucoup de variations possibles des éléments fondamentaux d'un cycle biologique avec alternance des générations. Chaque variation peut se produire séparément ou en combinaison, ce qui conduit à une diversité déconcertante de cycles biologiques. Les termes utilisés par les botanistes pour décrire ces cycles biologiques peuvent aussi être déroutants. Comme l'ont dit Bateman et Dimichele « […] l'alternance de générations est devenue un bourbier terminologique ; souvent, un terme représente plusieurs concepts ou un concept est représenté par plusieurs termes »[17]. Les variations possibles sont les suivantes :
Il existe des corrélations entre ces variations, mais ce ne sont que des corrélations, et pas des liens absolus. Par exemple, chez les plantes à fleurs, les microspores produisent finalement des microgamètes (mâles) et les mégaspores produisent finalement des mégagamètes (femelles). Cependant, chez les fougères et leurs alliés, il existe des groupes ayant des spores indifférenciées mais avec des gamétophytes différenciées. Par exemple, la fougère, Ceratopteris thalictrioides, a des spores d'un seul type, qui varie continûment en taille. Les spores les plus petites tendent à germer en gamétophytes ne produisant que des anthéridies productrices de spermatozoïdes[24]. Un cycle biologique complexe Le diagramme ci-contre montre l'alternance de générations chez une espèce qui est hétéromorphe, sporophytique, oogamique, hétérosporique et dioïque. Un exemple de plante à graines pourrait être le saule (la plupart des espèces du genre Salix sont dioïques)[25]. En partant du centre du diagramme, les processus impliqués sont les suivants :
Cycles biologiques des différents groupes de plantesLe terme « plante » est pris ici au sens d'Archaeplastida, c'est-à-dire les glaucophytes, les algues rouges et vertes et les plantes terrestres. L'alternance de générations se produit chez presque toutes les algues rouge et vertes multicellulaires, tant chez les formes d'eau douce (comme Cladophora ) que chez les algues marines (comme Ulva). En général, les générations sont homomorphes (isomorphes) et ont une existence autonome. Certaines espèces d'algues rouges ont une alternance de générations complexe, à trois phases, dont une phase de gamétophyte et deux phases distinctes de sporophyte. Les plantes terrestres ont toutes une alternance de générations hétéromorphe (anisomorphe), dans lequel le sporophyte et le gamétophyte sont nettement différents. Chez les embryophytes, le cycle devient de plus en plus hétéromorphe avec « une réduction de plus en plus importante du gamétophyte (aussi bien en taille qu'en durée de vie) : Bryophytes, Ptéridophytes de type Polypodium, Selaginella, Marsilea, Spermatophytes où il devient microscopique). Cela va de pair avec la sexualisation du sporophyte. D'abord nulle (un seul type de spores chez Funaria (en) et Polypodium), puis faible (tendance à l'existence de deux types de spores chez Equisetum), moyenne (deux types de sporanges et de spores chez les Ptéridophytes hétérosporés), forte chez les plantes à fleurs hermaphrodites et monoïques (étamines et carpelles) et enfin totale chez les plantes dioïques où la séparation des sexes est permanente. Cette réduction progressive s'accompagne d'une protection de plus en plus grande de la phase haploïde[26] ».
Chez les fougères et de leurs alliés, y compris les lycopodes et les prêles, l'organisme le plus remarquable observé sur le terrain est le sporophyte diploïde. Les spores haploïdes se développent dans des sores à la face inférieure des frondes et sont dispersées par le vent (parfois en flottant sur l'eau). Si les conditions sont favorables, une spore va germer et former un organisme plutôt discret appelé prothalle. Le prothalle haploïde ne ressemble pas au sporophyte, et de ce fait les fougères et leurs alliés ont une alternance de générations hétéromorphe. Le prothalle a une courte durée de vie, mais c'est lui qui réalise la reproduction sexuée, conduisant à la formation du zygote diploïde, qui pousse alors à partir du prothalle en tant que sporophyte.
Chez les spermatophytes, ou plantes à graines, le sporophyte est la phase multicellulaire dominante ; les gamétophytes sont fortement réduits en taille et de morphologie très différente. La totalité de la génération du gamétophyte, à la seule exception des grains de pollen (microgamétophytes), est contenue dans le sporophyte. Le cycle biologique d'une plante à fleurs (angiosperme) dioïque , le saule, a été décrit plus haut (Un cycle biologique complexe). Le cycle biologique d'un gymnosperme est similaire. Cependant, les plantes à fleurs ont en plus un phénomène appelé « double fécondation ». Deux noyaux de spermatozoïdes provenant d'un grain de pollen (microgamétophyte), au lieu d'un seul spermatozoïde, pénètrent dans l'archégone du mégagamétophyte ; l'un fusionne avec le noyau de l'oosphère pour former le zygote, les autres fusionnent avec deux autres noyaux du gamétophyte pour former l'endosperme, qui nourrit l'embryon au cours de son développement. Émergence évolutive de la phase diploïde dominante Une hypothèse est que la base de l'émergence de la phase diploïde du cycle biologique (sporophyte) comme phase dominante (par exemple chez les plantes vasculaires) pourrait être que la diploïdie autorise le masquage de l'expression de mutations délétères par complémentation génétique[27],[28]. Ainsi, si l'un des génomes parentaux dans les cellules diploïdes contenait des mutations conduisant à des défauts dans un ou plusieurs produits géniques, ces lacunes pourraient être compensées par l'autre génome parental (qui pourrait néanmoins avoir ses propres défauts dans d'autres gènes). À mesure que la phase diploïde devenait prédominante, l'effet de masquage a sans doute permis l'accroissement de la taille du génome, et donc du contenu en information, sans la contrainte d'avoir une meilleure précision de la réplication de l'ADN. La possibilité d'augmenter le contenu en information à faible coût fut avantageuse, car elle a permis d'encoder de nouvelles adaptations. Ce point de vue a été contesté, avec des preuves montrant que la sélection est plus efficace dans les phases haploïdes que dans les phases diploïdes du cycle biologiques des mousses et des angiospermes[29]. Toujours est-il que le cycle de développement diphasique avec dominance du sporophyte a été sélectionné au cours de l'évoolution. De plus, chez les Spermatophytes, le gamétophyte est miniaturisé : le gamétophyte mâle (contenu du grain de pollen) et femelle (sac embryonnaire) sont devenus microscopiques.
Processus similaires chez d'autres organismesChromalveolataCertains organismes classés dans les Chromalveolata, qui ne sont donc pas des plantes au sens utilisé dans cet article, présentent une alternance de générations. Les Foraminifères subissent une alternance de générations hétéromorphe entre les formes haploïde, « Gamontes », et diploïde, « Schizontes ». L'organisme haploïde unicellulaire est généralement beaucoup plus grand que l'organisme diploïde. Champignons (Fungi)Les mycéliums fongiques sont généralement haploïdes. Lorsque des mycéliums de types sexuels différents se rencontrent, ils produisent deux cellules multinucléées en forme de balle, qui se rejoignent via un « pont d'accouplement ». Les noyaux se déplacent d'un mycélium à l'autre, formant un « hétérocaryon » (« différents noyaux »). Ce processus est appelé « plasmogamie ». La fusion réelle pour former des noyaux diploïdes est appelée «caryogamie », et ne peut pas se produire avant que les sporanges soient formés. La caryogamie produit un zygote diploïde, sporophyte éphémère qui subit rapidement la méiose pour former des spores haploïdes. Lorsque les spores germent, elles se développent en nouveaux mycéliums. MyxomycètesLe cycle biologique des myxomycètes est très similaire à celui des champignons. Les spores haploïdes germinent pour former des cellules d'essaimage ou « myxamoebae ». Ils fusionnent dans un processus appelé « plasmogamie » et « caryogamie » pour former un zygote diploïde. Le zygote se développe en un plasmode qui, arrivé à maturité, produit selon les espèces une ou plusieurs fructifications contenant des spores haploïdes. AnimauxL'alternance entre générations diploïde multicellulaire et haploïde multicellulaire ne se rencontre jamais chez les animaux[30]. Chez certains animaux, il existe une alternance entre phases de parthénogénèse et de reproduction sexuelle (hétérogamie). Les deux phases sont diploïdes. Ce processus a parfois été appelé « alternance de générations »[31], mais c'est tout à fait différent. Notes et références
Voir aussiArticles connexes
Bibliographie
|