|
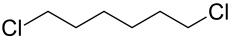
| 1,6-Dichlorohexane
|
|
| Identification |
| Nom UICPA
|
1,6-dichlorohexane
|
| Synonymes
|
chlorure d'hexaméthylène, dichlorhexane
|
| No CAS
|
2163-00-0
|
| No ECHA
|
100.016.811 |
| No CE
|
218-491-7
|
| PubChem
|
16551
|
| SMILES
|
|
| InChI
|
InChI : vue 3D InChI=1S/C6H12Cl2/c7-5-3-1-2-4-6-8/h1-6H2 InChIKey : OVISMSJCKCDOPU-UHFFFAOYSA-N |
| Apparence
|
liquide incolore à jaunâtre[1]
|
| Propriétés chimiques |
| Formule
|
C6H12Cl2 [Isomères]
|
| Masse molaire[2]
|
155,065 ± 0,01 g/mol
C 46,47 %, H 7,8 %, Cl 45,73 %,
|
| Propriétés physiques |
| T° fusion
|
−13 °C[1]
|
| T° ébullition
|
116-117 °C[1]
204 °C[3]
87-90 °C à 15 mmHg[4]
|
| Solubilité
|
eau : 0,9 g·l-1 à 20 °C[1]
|
| Masse volumique
|
1,07 g·cm-3 à 18 °C[1]
1,068 g·cm-3 à 25 °C[4]
|
| Point d’éclair
|
77 °C (coupelle fermée)[4]
|
| Pression de vapeur saturante
|
23 hPa à 92 °C[1]
|
| Propriétés optiques |
| Indice de réfraction
|
1,4572[5]
 = 1,457[4] = 1,457[4]
|
| Précautions |
| SGH[1],[4] |
H315, H319, H335, H413, P261, P273 et P305+P351+P338H315 : Provoque une irritation cutanée
H319 : Provoque une sévère irritation des yeux
H335 : Peut irriter les voies respiratoires
H413 : Peut entraîner des effets néfastes à long terme pour les organismes aquatiques
P261 : Éviter de respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols.
P273 : Éviter le rejet dans l’environnement.
P305+P351+P338 : En cas de contact avec les yeux : rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer.
|
| Transport[4] |
Numéro ONU :3082 : MATIÈRE DANGEREUSE DU POINT DE VUE DE L’ENVIRONNEMENT, LIQUIDE, N.S.A. Classe :9 Étiquette : 9 9 : Matières et objets dangereux divers Emballage :Groupe d'emballage III : matières faiblement dangereuses. |
| Écotoxicologie |
| LogP
|
(octanol/eau) 3,800[3]
|
|
| Unités du SI et CNTP, sauf indication contraire. |
modifier  |
Le 1,6-dichlorohexane est un composé organique du groupe des alcanes halogènes, les chloroalcanes plus exactement. Il a la structure de base de l'hexane avec sur chacun des deux atomes de carbone terminaux un substituant chloro.
Synthèse
Ce composé peut être préparé par la réaction du 1,6-hexanediol avec du chlorure de thionyle en présence d'une base telle que la pyridine[6]. La base déprotone l'alcool qui peut alors entamer une attaque nucléophile sur l'atome de soufre du chlorure de thionyle. Ensuite un ion chlorure sépare le composé soufre oxydé pour donner le produit.
Utilisation
Les ions chlorure sont de bons groupes partants, des nucléophiles peuvent effectuer facilement des substitutions sur ces positions.
La réaction de cyclisation avec de l'hydroxyde de potassium et du formiate de sodium permet d'obtenir de l'oxépane[7].
Notes et références
- ↑ a b c d e f g et h Entrée du numéro CAS « 2163-00-0 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 19/07/2008 (JavaScript nécessaire).
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a et b (en) « 1,6-Dichlorohexane », sur ChemIDplus.
- ↑ a b c d e et f Fiche Sigma-Aldrich du composé 1,6-Dichlorohexane 98%, consultée le 29/09/2016. + Fiche MSDS
- ↑ A. Müller, W. Vanc, 6-Chlor-hexanol-(1), Chlor- und Oxy-äther aus Hexandiol-(1,6)., Monatsh. Chem., 1947, vol. 77, pp. 259–263.
- ↑ F. Asinger, B. Fell, H. Scherb, Zur Kenntnis der Produkte der gemeinsamen Einwirkung von Schwefeldioxyd und Chlor auf aliphatische Kohlenwasserstoffe im ultravioletten Licht, XI. Über die Zusammensetzung der Sulfochlorierungsprodukte von n-Hexan-sulfochlorid-(1), Chem. Ber., 1963, vol. 96, p. 2831–2840.
- ↑ H. A. Zahalka, Y. Sasson, One-pot conversion of primary alkyl chlorides and dichlorides into alcohols, diols, and ethers via formic ester intermediates under phase-transfer conditions, Synthesis, 1986, vol. 9, p. 763–765.
Articles connexes
|


