|
Ácido fosfórico
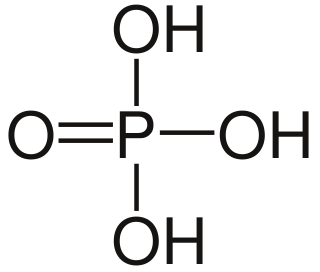
El ácido fosfórico (a veces llamado ácido ortofosfórico) es un ácido (más precisamente un compuesto ternario que pertenece a la categoría de los oxácidos) de fórmula H3PO4.[2] Es un ortofosfato cuyo código en el Sistema Internacional de Numeración es E-338. No se debe usar agua para eliminar este químico, puesto que esta produce su activación. Se suele encontrar en forma de solución acuosa al 85%, que es un líquido en forma de jarabe incoloro, inodoro y no volátil. Es un importante producto químico industrial, ya que es un componente de muchos fertilizantes. El compuesto es un ácido. La eliminación de los tres iones H+ El nombre "ácido ortofosfórico" puede utilizarse para distinguir este ácido específico de otros "ácidos fosfóricos", como el ácido pirofosfórico. Sin embargo, el término "ácido fosfórico" a menudo significa este compuesto específico; y esa es la actual nomenclatura IUPAC. Propiedades químicasEl anión asociado al ácido fosfórico se llama ion fosfato, muy importante en la biología, especialmente en los compuestos derivados de los azúcares fosforilados, como el ADN, el ARN y la adenosina trifosfato (ATP). En su forma pura, este ácido es un sólido cristalino de color blanco, higroscópico y delicuescente. Con mayor frecuencia, el ácido fosfórico se almacena y distribuye en solución: en esta presentación, tiene un aspecto líquido transparente, ligeramente amarillento. Se obtiene mediante el tratamiento de rocas de fosfato de calcio con ácido sulfúrico, filtrando posteriormente el líquido resultante para extraer el sulfato de calcio. Otro modo de obtención consiste en quemar vapores de fósforo y tratar el óxido resultante con vapor de agua. El ácido fosfórico es un ácido triprótico. Esto significa que puede disociarse en agua hasta tres veces, liberando cada vez un protón al agua como se muestra en las siguientes reacciones: Sistema eutécticoEl diagrama de fases del sistema H El ácido fosfórico concentrado tiende a superenfriarse antes de que se produzca la cristalización, y puede ser relativamente resistente a la cristalización incluso cuando se almacena por debajo del punto de congelación.[6] Para muchos usos industriales, el 85% representa un límite superior práctico, ya que con concentraciones más altas se corre el riesgo de que toda la masa se congele cuando se transporta en camiones cisterna y tenga que fundirse, aunque aún puede producirse una cristalización parcial a temperaturas bajo cero. AutocondensaciónEl ácido fosfórico se comercializa en soluciones acuosas de diversas concentraciones, que no suelen superar el 85%. Si se concentra más, sufre una lenta autocondensación, formando un equilibrio con ácido pirofosfórico: Incluso a una concentración del 90% la cantidad de ácido pirofosfórico presente es despreciable, pero más allá del 95% comienza a aumentar, alcanzando el 15% en lo que de otro modo habría sido un 100% de ácido ortofosfórico.[7] A medida que aumenta la concentración se forman ácidos superiores, que culminan con la formación de ácidos polifosfóricos.[8] No es posible deshidratar completamente el ácido fosfórico a pentóxido de fósforo, sino que el ácido polifosfórico se vuelve cada vez más polimérico y viscoso. Debido a la autocondensación, el ácido ortofosfórico puro sólo puede obtenerse mediante un cuidadoso proceso de congelación/fusión fraccionada.[6] Propiedades físicas
Usos No es un ácido fuerte ya que su menor pKa es 2,14. El ácido es muy útil en el laboratorio debido a su resistencia a la oxidación, a la reducción, a la evaporación (comparado con HCl) y a la carbonizacion (comparado con el ácido sulfúrico). Entre otras aplicaciones se utiliza como catalizador en la deshidratación de alquenos,[9] esterificación,[10] o reacción de Friedel-Craft.[11] El ácido fosfórico se emplea como ingrediente de bebidas no alcohólicas como por ejemplo de las gaseosas, así como (aditivo alimentario E-338), de un modo particular en las de tipo cola; como elemento acondicionador de la superficie del esmalte dental, pues al desmineralizar la superficie del mismo genera microtenciones en su estructura lo cual facilita la adhesión de los materiales de restauración dental ; como catalizador, para proteger aleaciones ferrosas, por formación de fosfatos de hierro insolubles, y para fabricar el tripolifosfato de sodio utilizado como ablandadores de agua, fertilizantes y detergentes. Muy utilizado en laboratorios químicos en la preparación de disoluciones tampón o reguladoras del pH. La neutralización del ácido fosfórico con el amoniaco produce Fosfato Monoamónico (MAP), un fertilizante complejo altamente concentrado que contiene nitrógeno y fósforo aprovechable.[12] También se usa para aditivo al mezclar con aceite urea, brea, betún, piedrilla con arena para crear un asfalto para pavimento en suelos de carreteras y reparaciones de roturas en suelo con solo agregar agua para activar, derretir el asfalto y compactar mediante aplanadora. Si se le añade fluoruro de sodio se obtiene monofluorofosfato de sodio (MFP), componente de algunas cremas dentales. Uso en alimentaciónEl ácido fosfórico de uso alimentario (aditivo E338[13][14]) se utiliza para acidificar alimentos y bebidas, como diversas colas y mermeladas, lo que les confiere un sabor ácido. El ácido fosfórico también sirve como conservante.[15] Los refrescos que contienen ácido fosfórico, entre los que se incluirían los de tipo cola, a veces se denominan refrescos fosfatados o fosfáticos. El ácido fosfórico de los refrescos puede causar erosión dental[16] y también puede contribuir a la formación de cálculos renales, sobre todo en personas que ya los han padecido.[17] También puede causar desmineralización ósea (hacer que los huesos pierdan calcio), conduciendo a enfermedades como la osteopenia y la osteoporosis. Las especificaciones del ácido fosfórico de uso alimentario como aditivo E338 están publicadas por la Unión Europea.[18] ProducciónEl ácido fosfórico se produce industrialmente por una de estas dos vías: por vía húmeda y por vía seca.[19] Proceso húmedoEn el proceso húmedo, un mineral que contiene fosfato, como la hidroxiapatita cálcica y la fluorapatita, es digerido con ácido sulfúrico
El sulfato de calcio (yeso) es un subproducto, que se elimina como fosfoyeso. El gas de fluoruro de hidrógeno (HF) se conduce a un lavador húmedo (de agua) que produce ácido fluorhídrico. En ambos casos, la solución de ácido fosfórico suele contener un 23-33% de P2O5 (32-46% de H3PO4). Puede concentrarse para producir ácido fosfórico de grado comercial o mercantil, que contiene aproximadamente 54-62% de P2O5 (75-85% de H3PO4). Una mayor eliminación de agua produce ácido superfosfórico con una concentración de P2O5 superior al 70% (correspondiente a casi el 100% de H3PO4). El ácido fosfórico de ambos procesos puede purificarse aún más eliminando compuestos de arsénico y otras impurezas potencialmente tóxicas. Proceso en secoPara producir ácido fosfórico de calidad alimentaria, el mineral de fosfato se reduce primero con coque en un horno de arco eléctrico, para obtener fósforo elemental. También se añade sílice, con lo que se produce escoria de silicato cálcico. El fósforo elemental se destila del horno y se quema con aire para producir pentóxido de fósforo de gran pureza, que se disuelve en agua para producir ácido fosfórico.[20] SeguridadEl ácido fosfórico no es un ácido fuerte. Sin embargo, en concentraciones moderadas las soluciones de ácido fosfórico son irritantes para la piel. El contacto con soluciones concentradas puede causar quemaduras graves en la piel y daños permanentes en los ojos.[21] Se ha demostrado una relación entre el consumo regular de cola a largo plazo y la osteoporosis en la mediana edad tardía en mujeres (pero no en hombres).[22] Véase tambiénReferencias
Enlaces externos
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia