|
Ácido brómico
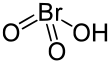
El ácido brómico (HBrO3) es un oxácido del bromo, cuyo estado de oxidación es 5. Es poco estable y solo puede disponerse en solución acuosa,[2][3] pues se descompone con relativa facilidad si se intenta concentrar. Esto hace, que incluso las disoluciones diluidas de este ácido, inicialmente incoloras, a temperatura ambiente cambien lentamente a color marrón debido a la presencia de bromo molecular.[4]Tanto el ácido brómico como sus sales, los bromatos, son poderosos agentes oxidantes, al igual que los cloratos. Contiene aproximadamente 62% de bromo, 1 % de hidrógeno y 37% de oxígeno. ObtenciónEn el laboratorio se obtiene como producto de reacción del bromato de bario con el ácido sulfúrico. [3]
El sulfato de bario que se obtiene como subproducto es muy poco soluble en agua, por lo que precipita, pudiéndose separar del ácido brómico por decantación o filtración. También puede separarse por destilación, recogiendo los vapores en agua destilada que luego puede concentrarse hasta un 50 % mediante evaporación lenta a vacío y a baja temperatura (−12 °C)[5] A escala industrial se obtiene por oxidación del bromo molecular (Br2) con oxígeno en presencia de catalizadores, para formar ácido hipobromoso, HBrO, que posteriormente se oxida a ácido brómico haciendo pasar una corriente de cloro molecular (Cl2) o mediante la adición de dióxido de manganeso, MnO2. También puede obtenerse mediante oxidación electrolítica, por electrólisis de una disolución que contenga algún bromuro soluble. Mediante este proceso se obtienen diferentes productos, entre ellos el HBrO3.[6] PropiedadesEn estado puro y a temperatura ambiente se presenta como unas sustancia incolora, con punto de fusión de 49 °C. A temperatura próxima a los 100 °C se descompone en bromo y oxígeno. Es bastante soluble en agua, disociándose completamente cuando se encuentra en disoluciones diluidas. A concentraciones altas se descompone formando bromo molecular. La alta inestabilidad del ácido brómico se puede explicar porque el bromo hipervalente cargado positivamente está conectado al grupo OH electronegativo.[7] AplicacionesA lo largo de los años, desde su descubrimiento en 1832 por el químico francés Antoine Jérôme Balard, se han llevado a cabo numerosos estudios para comprender tanto sus propiedades como sus aplicaciones en diversos campos científicos. En la industria química se utiliza en procesos de síntesis orgánica por bromación y en procesos de oxidación selectiva, dadas sus propiedades altamente oxidantes.[6] Véase tambiénReferencias
Enlaces externos |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia