|
Transposición de CarrollLa transposición de Carroll es una reacción orgánica que consiste en la transformación de un β-cetoalil éster en un ácido α-alil-β-cetocarboxílico.[1] Esta reacción orgánica está precedida por una descarboxilación y el producto final es una γ, δ enona. La transposición de Carroll es una adaptación de la transposición de Claisen y fue observada por primera vez en 1940 por Michael Francis Carroll. Mecanismo de reacciónLa transposición de Carroll (1940) en presencia de base y con la reacción de alta temperatura (rutaA) se lleva a cabo a través de un enol como intermediario que luego sufre una transposición de Claisen. La siguiente etapa es una descarboxilación. Con paladio (0) como catalizador, la reacción (Tsuji, 1980) es mucho más suave (ruta B) con un complejo - catión alílico - anión carboxílato - paladio como intermediario]].[2]  La descarboxilación precedida por la alilación es evidenciada por su reacción catalizada por tetrakis(trifenilfosfina)paladio(0)]]:[3] 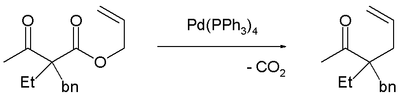 Alilación descarboxilativa asimétricaIntroducuiendo auxiliares quirales adecuados, la reacción se vuelve enantioselectiva.[4] Se ha reportado una transposición asimétrica catalizada por tris(dibencillidenacetona)dipaladio (0) y el ligando de Trost.[3] 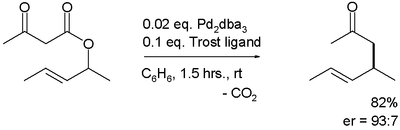 Una reacción similar[5] emplea naftol.  Esta reacción obtiene un enantiómero con el 88% de ee. Resta comprobar si esta reacción tendrá un amplio alcance porque el grupo de acetamido parece ser un requisito previo. El mismo catalizador, pero con un ligando diferente, se emplea en esta reacción enantioconvergente.:[6] 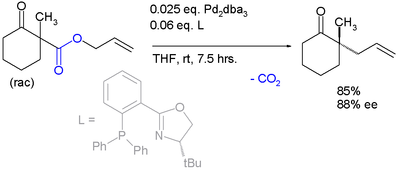 El ámbito de aplicación se extiende a la α-alquilación asimétrica de cetonas utilizando el carbonato de alil - alquenilo correspondiente.:[7]  Referencias
|
Portal di Ensiklopedia Dunia