|
Transposición de Meyer–SchusterLa transposición de Meyer-Schuster es una reacción química orgánica descrita como la transposición catalizada por un ácido de alcoholes propargílicos secundarios y terciarios a cetonas α, β-insaturadas cuando el alquino sea interno, y aldehídos α, β-insaturados si el alquino es terminal. Swaminathan y Narayan, Vartanyan y Banbanyan, y Engel y Dudley han publicado revisiones, la última de las cuales describe formas de promover la transposición de Meyer-Schuster sobre otras reacciones disponibles para los alcoholes propargílicos.[1][2][3] 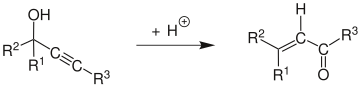 La condensación catalizada por bases se denomina reacción de Favorskii. Mecanismo El mecanismo de reacción[4] comienza con la protonación del alcohol que sale en una reacción E1 para formar el aleno a partir del alquino. El ataque de una molécula de agua sobre el carbocatión y la desprotonación va seguido de tautomerización para dar el compuesto carbonilo α, β-insaturado. Edens Et al. ha investigado el mecanismo de reacción.[5] Descubrieron que se caracterizaba por tres pasos principales: (1) la protonación rápida de oxígeno, (2) el paso lento que determina la velocidad que comprende el desplazamiento 1,3 del grupo hidroxi protonado y (3) el ceto-enol tautomería seguida de una rápida desprotonación. En un estudio del paso limitante de la velocidad de la reacción de Meyer-Schuster, Andres et al. demostró que la fuerza impulsora de la reacción es la formación irreversible de compuestos carbonílicos insaturados a través de iones carbonio.[6] También encontraron que la reacción era asistida por el solvente. Esto fue investigado más a fondo por Tapia et al. que mostró un clatrato de disolvente estabiliza el estado de transición.[7] Transposición de RupeLa reacción de alcoholes terciarios que contienen un grupo α-acetilénico no produce los aldehídos esperados, sino metilcetonas α, β-insaturadas a través de un intermedio enino.[8][9] Esta reacción alternativa se llama reacción de Rupe y compite con la transposición de Meyer-Schuster en el caso de los alcoholes terciarios..   Uso de catalizadoresMientras que el reordenamiento tradicional de Meyer-Schuster usa condiciones severas con un ácido fuerte como catalizador, esto introduce competencia con la reacción de Rupe si el alcohol es terciario.[1] Las condiciones más suaves han sido utilizadas exitosamente con metal de transición-basado y catalizadores de ácido del Lewis (por ejemplo, Ru- y Ag-basó catalizadores).[10][11] Se han utilizado con éxito condiciones más suaves con catalizadores ácidos de Lewis y basados en metales de transición (por ejemplo, catalizadores basados en Ru y Ag). Cadierno y colaboradores informaron del uso de radiación de microondas con InCl como catalizador para dar excelentes rendimientos con tiempos de reacción cortos y estereoselectividad notable.[12] Un ejemplo de su publicación se muestra a continuación: 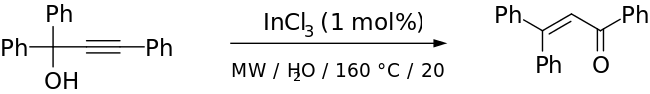 AplicacionesLa transposición de Meyer-Schuster se ha utilizado en una variedad de aplicaciones, desde la conversión de lactamas ω-alquinil-ω-carbinol en enamidas utilizando PTSA catalítico hasta la síntesis de tioésteres α, β-insaturados de alcoholes propargílicos γ-azufrados sustituidos reordenamiento de 3-alquinil-3-hidroxil-1H-isoindoles en condiciones ligeramente ácidas para dar los compuestos de carbonilo α, β-insaturados.[13][14][15] Una de las aplicaciones más interesantes, sin embargo, es la síntesis de una parte de paclitaxel en una forma diastereoméricamente selectiva que conduce solo al E-alqueno.[16]  El paso que se muestra arriba tuvo un rendimiento del 70% (91% cuando el subproducto se convirtió en el producto Meyer-Schuster en otro paso). Los autores utilizaron el reordenamiento de Meyer-Schuster porque querían convertir una cetona impedida en un alqueno sin destruir el resto de su molécula. Referencias
Véase también |
Portal di Ensiklopedia Dunia