|
Transposición alílicaUna transposición alílica es una reacción orgánica en la cual el doble enlace de un compuesto alílico se intercambia al siguiente átomo de carbono. Se encuentra cuando hay un grupo saliente en un grupo alilo. En las condiciones de reacción que favorecen el mecanismo de reacción SN1, el intermediario es un carbocatión en donde la estabilización por resonancia es favorable. Alternativamente, es posible un ataque del nucleófilo en la posición alílica en condiciones SN2. Esto se lleva a cabo cuando la posición alílica no presenta impedimento estérico. Es así como procede la reacción de 1-cloro-2-buteno con hidróxido de sodio para dar una mezcla de 2-buten-1-ol y 1-buten-3-ol: Sin embargo, hay ocasiones donde el producto en el cual el grupo hidroxilo se encuentra en el átomo de carbono primario es minoritario. El alcohol secundario 1-cloro-3-metil-2-buteno produce el alcohol terciario 2-metil-3-buten-2-ol tiene un rendimiento de 85%, mientras que el alcohol primario 3-metil-2-buten-1-ol es de 15%. En el mecanismo de reacción propuesto, el nucleófilo no ataca directamente al carbono electrofílico, sino a la doble ligadura en un mecanismo de adición al carbono vinílico con desplazamiento del grupo saliente, la cual es denominada transposición alílica. AplicacionesLa utilidad sintética de esta reacción se puede extender a sustitución en enlaces del butadieno:[1]
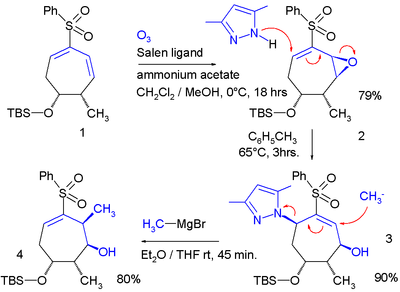
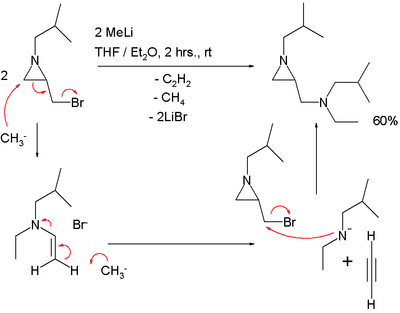
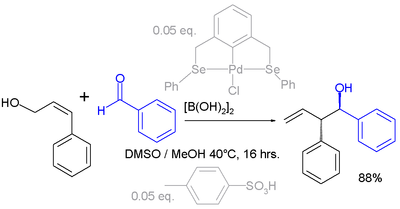
En el primer paso de esta macrociclización, el grupo tiol en el extremo del 1,5-pentanoditiol reacciona con el butadieno en el paso 1 para dar la enona 2 en un intercambio alílico con una sulfona como grupo saliente. Éste reacciona posteriormente con el otro extremo en una reacción de adición conjugada. En un estudio llevado a cabo por Ahmad y colaboradores,[2] el intercambio alílico fue aplicado dos veces en un sistema cíclico: En esta secuencia de reacciones, una epoxidación de Jacobson añade un grupo epóxido a un dieno, el cual funciona como grupo saliente en la reacción con el pirazol nucleofílico. El reactivo de Grignard funciona como un nucleófilo capaz de desplazar al pirazol. Una reacción de SN2' puede explicar cómo procede la reacción de una aziridina que presenta un grupo bromuro de metileno con metiluro de litio:[3] En esta reacción se pierde un equivalente de acetileno. Algunas reaccione especiales que presentan una transposición alílica son la transposición de Ferrier y la transposición de Meyer–Schuster Reducción SN2'En una adaptación llamada reducción SN2', se produce una reducción orgánica formal de un grupo alilo que contiene un buen grupo saliente acompañado por una transposición. Un ejemplo de esta reacción se encuentra como parte de una síntesis total del Taxol (anillo C):[4] Se utiliza hidruro de litio y aluminio y el grupo saliente es una sal de fosfonio. El producto contiene un nuevo doble enlace exocíclico. Sólo cuando el anillo de ciclohexano es sustituido adecuadamente el protón se adicionará en una posición trans con respecto al grupo metilo adyacente. Una reacción conceptuelmente similar es la reacción de Whiting, en donde se forman dienos. Intercambios alílicos electrofílicosLos intercambios alílicos también pueden tener lugar con electrófilos. En el siguiente ejemplo, el grupo carbonilo del benzaldehído es activado por el ácido diborónico en la reacción con el alcohol alílico (V. reacción de Prins):[5][6] Referencias
|