|
Pentacloruro de tántalo
El pentacloruro de tántalo, también conocido como cloruro de tántalo (V), es un compuesto inorgánico de fórmula TaCl5. Se presenta en forma de polvo blanco y suele utilizarse como material de partida en la química del tántalo. Se hidroliza fácilmente para formar oxicloruro de tántalo (V) (TaOCl3) y, finalmente, pentóxido de tántalo (Ta2O5); esto requiere que se sintetice y manipule en condiciones anhidras, utilizando técnicas sin aire. EstructuraEl TaCl5 cristaliza en el grupo espacial monoclínico C2/m.[2]Los diez átomos de cloro definen un par de octaedros que comparten una arista común. Los átomos de tántalo ocupan los centros de los octaedros y están unidos por dos ligandos puente de cloro. La estructura dimérica se mantiene en disolventes no complejos y en gran medida en estado fundido. Sin embargo, en estado vapor, el TaCl5 es monomérico. Este monómero adopta una estructura trigonal bipiramidal, como la del PCl5.[3] Propiedades físicasLa solubilidad del pentacloruro de tántalo aumenta ligeramente para las siguientes series de hidrocarburos aromáticos: benceno < tolueno < m-xileno < mesitileno Esto se refleja en la intensificación del color de las soluciones de amarillo pálido a naranja. El pentacloruro de tántalo es menos soluble en ciclohexano y tetracloruro de carbono que en los hidrocarburos aromáticos. También se sabe que estas soluciones de pentacloruro de tántalo son malas conductoras de la electricidad, lo que indica poca ionización. El TaCl5 se purifica por sublimación para dar agujas blancas. SíntesisEl pentacloruro de tántalo puede prepararse haciendo reaccionar tántalo metálico en polvo con cloro gaseoso entre 170 y 250 °C. Esta reacción también puede realizarse utilizando HCl a 400 °C.[4] 2 Ta + 5 Cl2 → 2 TaCl5 2 Ta + 10 HCl → 2 TaCl5 + 5 H2 También puede prepararse mediante una reacción entre el pentóxido de tántalo y el cloruro de tionilo a 240 °C Ta2O5 + 5 SOCl2 → 2 TaCl5 + 5 SO2 El pentacloruro de tántalo está disponible comercialmente, pero las muestras pueden contaminarse con oxicloruro de tántalo (V) (TaOCl3), formado por hidrólisis. ReaccionesEl TaCl5 es electrófilo y se comporta como un catalizador de Friedel-Crafts, similar al AlCl3. Forma aductos con diversas bases de Lewis.[5] Aductos simplesEl TaCl5 forma complejos estables con éteres: TaCl5 + R2O → TaCl5(OR2) (R = Me, Et) El TaCl5 también reacciona con pentacloruro de fósforo y oxicloruro de fósforo, el primero como donante de cloruro y el segundo sirve como ligando, uniéndose a través del oxígeno: TaCl5 + PCl5 → [PCl+4][TaCl−6] TaCl5 + OPCl3 → [TaCl5(OPCl3)] El pentacloruro de tántalo reacciona con aminas terciarias para dar aductos cristalinos. TaCl5 + 2 R3N → [TaCl5(NR3)] Reacciones de desplazamiento de clorurosEl pentacloruro de tántalo reacciona a temperatura ambiente con un exceso de óxido de trifenilfosfina para dar oxicloruros: TaCl5 + 3 OPPh3 → [TaOCl3(OPPh3)]x ... A la presunta formación inicial de aductos entre TaCl5 y compuestos hidroxílicos como alcoholes, fenoles y ácidos carboxílicos le sigue inmediatamente la eliminación del cloruro de hidrógeno y la formación de enlaces Ta-O: TaCl5 + 3 HOEt → TaCl2(OEt)3 + 3 HCl En presencia de amoníaco como aceptor de HCl, los cinco ligandos cloruro se desplazan con formación de Ta(OEt)5. De forma similar el TaCl5 reacciona con metóxido de litio en metanol anhidro para formar derivados metoxi relacionados: TaCl5 + 4 LiOMe → Ta(OMe)4Cl + 4 LiCl Amonólisis y alcohólisis y reacciones relacionadasEl amoníaco desplazará la mayoría de los ligandos de cloruro de TaCl5 para dar un cluster. El cloruro es desplazado más lentamente por aminas primarias o secundarias, pero la sustitución de los cinco centros de cloruro por grupos amido se ha conseguido mediante el uso de dialquilamidas de litio, como ilustra la síntesis de pentakis(dimetilamido)tántalo: TaCl5 + 5 LiNMe2 → Ta(NMe2)5 Con alcoholes, el pentacloruro reacciona para dar alcóxidos. Como se muestra para la preparación de etoxido de tántalo(V), tales reacciones se llevan a cabo a menudo en presencia de una base: 10 EtOH + Ta2Cl10 + 10 NH3 → Ta2(OEt)10 + 10 NH4Cl El pentacloruro de tántalo se reduce mediante heterociclos nitrogenados como la piridina. Reducción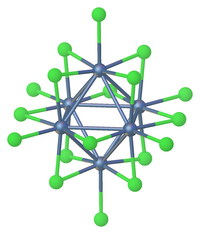 La reducción del cloruro de tántalo (V) da lugar a cúmulos aniónicos y neutros como [Ta6Cl18]4- y [Ta6Cl14](H2O)4.[7] Referencias
Otras lecturas
Enlaces externos
|
|||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia
