|
Inhibidor de la ribonucleasaEl inhibidor de la ribonucleasa (IR) es una proteína de gran tamaño (450 residuos, ~49 kDa), ácida (pI ~4.7) y rica en leucinas, que forma complejos muy estables con ciertas ribonucleasas. Forma aproximadamente el 0.1% de la masa proteica total de la célula, y parece que tiene un papel importante en la regulación del tiempo de vida medio del ácido ribonucleico.[1] El IR tiene alto porcentaje de cisteínas, de aproximadamente el 6.5%, frente al 1.7% en otras proteínas. También es rica en leucina (21.5%, comparado con el 9% en otras proteínas típicas) y una proporción mucho menor de residuos hidrofóbicos, especialmente valina, isoleucina, metionina, tirosina y fenilalanina. Estructura El inhibidor de la ribonucleasa es una proteína rica en leucina clásica, consistente en hélices alfa y láminas beta alternadas a lo largo de su esqueleto. Estos elementos de estructura secundaria se enrollan formando un solenoide dextrógiro que recuerda a una herradura. Las láminas beta y las hélices alfa forman la parte externa e interna de la herradura, respectivamente. La estructura parece que está estabilizada por la presencia de asparaginas enterradas en la base de cada giro, al alternar entre hojas beta y hélices alfa. Las repeticiones alfa-beta se dan cada 28-29 residuos, formando unidades de 57 residuos que se corresponden con su estructura genética, ya que cada exón codifica una unidad de 57 aminoácidos. Unión a ribonucleasas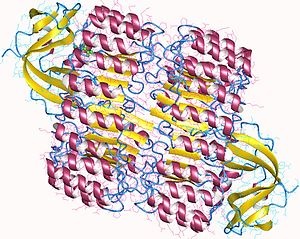 La afinidad del IR con la ribonucleasa es una de las más altas descubiertas; la constante de disociación del complejo IR-RNasa I en condiciones fisiológicas está en el rango femtomolar, mientras que para la IR-angiogenina está por debajo de 1 fM. A pesar de esta alta afinidad, el IR se puede unir a una amplia variedad de RNasas A aunque éstas tengan poca homología de secuencia. Estudios cristalográficos y bioquímicos de los complejos IR-RNasa A sugieren que la interacción es debida a interacciones electrostáticas, incluyendo también una parte de interacción entre superficies internas.[3][4] La afinidad de la IR por las ribonucleasas es importante, ya que muchas de ellas tienen efectos citotóxicos y citostáticos que se correlacionan bien con su habilidad para formar complejos con la IR.[5] Los IR de mamíferos son incapaces de unirse a determinadas ribonucleasas pancreáticas de otras especies. En concreto, las ribonucleasas de anfibios, como la ranpirnasa y la amfinasa de la rana leopardo del norte, no interaccionan con las IR de mamíferos y tienen diferentes efectos citotóxicos contra células cancerígenas.[6] Referencias
|
Portal di Ensiklopedia Dunia