|
Heptafluorotantalato de potasio
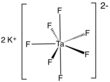
El heptafluorotantalato de potasio es un compuesto inorgánico de fórmula K2[TaF7]. Es la sal potásica del anión heptafluorotantalato [TaF7]2-. Este sólido blanco soluble en agua es un producto intermedio en la purificación del tántalo a partir de sus minerales y es el precursor del metal.[2] PreparaciónIndustrialEl heptafluorotantalato de potasio es un producto intermedio en la producción industrial de tántalo metálico. Su producción implica la lixiviación de minerales de tántalo, como la columbita y la tantalita, con ácido fluorhídrico y ácido sulfúrico para producir el heptafluorotantalato de hidrógeno soluble en agua.[2] Ta2O5 + 14 HF → 2 H2[TaF7] + 5 H2O Esta solución se somete a una serie de pasos de extracción líquido-líquido para eliminar las impurezas metálicas (la más importante, el niobio) antes de ser tratada con fluoruro de potasio para producir K2[TaF7] H2[TaF7] + 2 KF → K2[TaF7] + 2 HF A escala de laboratorioEl ácido fluorhídrico es corrosivo y tóxico, por lo que resulta poco atractivo para trabajar con él; por ello, se han desarrollado varios procesos alternativos para síntesis a pequeña escala. El heptafluorotantalato de potasio puede producirse por métodos anhidro y húmedo. El método anhidro implica la reacción del óxido de tántalo con bifluoruro de potasio o bifluoruro de amonio según la siguiente ecuación:[3] Ta2O5 + 4 KHF2 + 6 HF → 2 K2[TaF7] + 5 H2O El método fue comunicado originalmente por Berzelius.[4] El K2[TaF7] también puede precipitarse a partir de soluciones en ácido fluorhídrico siempre que la concentración de HF sea inferior a aproximadamente el 42%. Las soluciones con concentraciones más altas de HF producen hexafluorotantalato de potasio [KTaF6]. La sal K también puede precipitarse a partir de una solución en ácido fluorhídrico de pentacloruro de tántalo: 5 HF + 2 KF + TaCl5 → K2[TaF7] + 5 HCl ReaccionesEl K2[TaF7] se utiliza principalmente para producir tántalo metálico mediante reducción con sodio. Esto tiene lugar a aproximadamente 800 °C en sal fundida y se produce a través de una serie de vías potenciales.[5] K2[TaF7] + 5 Na → Ta + 5 NaF + 2 KF El K2[TaF7] es susceptible de hidrólisis. Por ejemplo, una solución acuosa en ebullición de K2[TaF7] produce oxifluorotantalato de potasio (K2Ta2O3F6), conocido como "sal de Marignac". Para evitar la hidrólisis y la coprecipitación del oxifluorotantalato de potasio, se añade un pequeño exceso de HF a la solución. Referencias
Enlaces externos
|
|||||||||||||||||||||||||||||||||