|
Acoplamiento de KumadaEn química orgánica, el acoplamiento de Kumada o acoplamiento de Kumada-Corriu es un tipo de reacción de acoplamiento cruzado, útil para generar enlaces carbono-carbono mediante la reacción de un reactivo de Grignard y un haluro orgánico:
El procedimiento utiliza catalizadores de metales de transición, típicamente níquel o paladio, para acoplar una combinación de dos grupos alquilo, arilo o vinilo. Los grupos de Robert Corriu y Makoto Kumada informaron de la reacción de forma independiente en 1972.[1][2] La reacción es destacable por ser uno de los primeros métodos de acoplamiento cruzado catalítico reportados. A pesar del desarrollo posterior de reacciones alternativas (Suzuki, Sonogashira, Stille, etc), el acoplamiento de Kumada se sigue empleando en muchas aplicaciones sintéticas, incluida la producción a escala industrial de aliskiren, un medicamento para la hipertensión, y politiofenos, útiles en dispositivos electrónicos orgánicos. HistoriaLas primeras investigaciones sobre el acoplamiento catalítico de reactivos de Grignard con haluros orgánicos se remontan al estudio de 1941 de catalizadores de cobalto realizado por Morris S. Kharasch y E. K. Fields.[3] En 1971, Tamura y Kochi desarrollaron este trabajo en una serie de publicaciones que demostraban la viabilidad de los catalizadores a base de plata,[4] cobre[5] y hierro.[6] Sin embargo, estos primeros enfoques produjeron bajos rendimientos debido a la formación sustancial de productos de homoacoplamiento, donde se acoplan dos especies idénticas. Estos esfuerzos culminaron en 1972, cuando los grupos de Corriu y Kumada informaron simultáneamente sobre el uso de catalizadores que contenían níquel. Con la introducción de catalizadores de paladio en 1975 por parte del grupo de Murahashi, el alcance de la reacción se amplió aún más.[7] Posteriormente, se han desarrollado muchas técnicas de acoplamiento adicionales, que culminaron con el reconocimiento del Premio Nobel de Química en 2010 a Eiichi Negishi, Akira Suzuki y Richard Heck por sus contribuciones al campo. Mecanismo de reacciónCatálisis con paladioDe acuerdo con el mecanismo ampliamente aceptado, se entiende que el acoplamiento de Kumada catalizado por paladio es análogo al papel del paladio en otras reacciones de acoplamiento cruzado. El ciclo catalítico propuesto involucra estados de oxidación de paladio (0) y paladio (II). Inicialmente, el catalizador de Pd(0) rico en electrones (1) se inserta en el enlace R-X del haluro orgánico. Esta adición oxidativa forma un complejo organo-Pd(II) (2). La transmetalación posterior con el reactivo de Grignard forma un complejo heteroorganometálico (3). Antes del siguiente paso, es necesaria la isomerización para llevar los ligandos orgánicos uno al lado del otro en posiciones mutuamente cis. Finalmente, la eliminación reductora de (4) forma un enlace carbono-carbono y libera el producto de acoplamiento cruzado mientras regenera el catalizador de Pd(0) (1):[8] 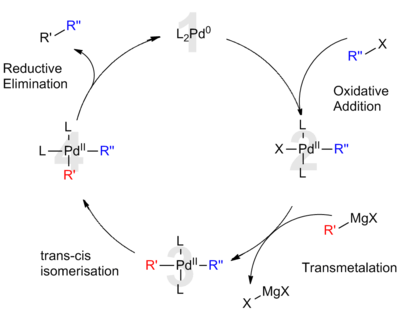 Para los catalizadores de paladio, la adición oxidante suele ser la etapa limitante de la velocidad y, con frecuencia, ocurre más lentamente que con los sistemas de catalizadores de níquel. Catálisis con níquelLa comprensión actual del mecanismo del acoplamiento catalizado por níquel es limitada. De hecho, se cree que el mecanismo de reacción procede de manera diferente bajo diferentes condiciones de reacción y cuando se usan diferentes ligandos de níquel.[9] En general, el mecanismo aún puede describirse como análogo al esquema de paladio:  Sin embargo, bajo ciertas condiciones de reacción, el mecanismo no logra explicar todas las observaciones. El examen realizado por Vicic y sus colaboradores, utilizando el ligando de terpiridina tridentado identificó intermediarios de un ciclo catalítico de Ni(II)-Ni(I)-Ni(III),[10] lo que sugiere un esquema más complicado. Además, con la adición de butadieno, se cree que la reacción involucra un intermedio de Ni(IV).[11] Selectividad químicaTanto los haluros de olefina cis como los trans promueven la retención general de la configuración geométrica cuando se combinan con un alquilo de Grignard. Esta observación es independiente de otros factores, incluida la elección de los ligandos del catalizador y los sustituyentes vinílicos.[12] 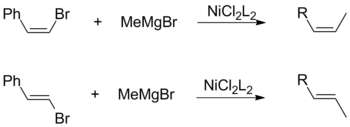 Por el contrario, un acoplamiento de Kumada que utiliza reactivos vinílicos de Grignard procede sin estereoespecificidad para formar una mezcla de alquenos cis y trans. El grado de isomerización depende de una variedad de factores, incluidas las proporciones de los reactivos y la identidad del grupo haluro. Según Kumada, esta pérdida de estereoquímica es atribuible a reacciones secundarias entre dos equivalentes del reactivo alílico de Grignard.[12]  Referencias
|
Portal di Ensiklopedia Dunia
