|
Thioketone
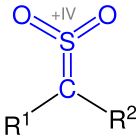
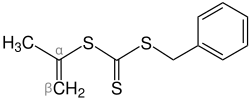
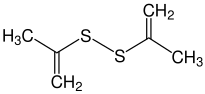
Thioketone (Thione) sind organische, chemische Verbindungen. Sie stellen die Schwefel-Analoga von Ketonen dar und gehören zu den Thiocarbonylverbindungen.[1] Ihre funktionelle Gruppe besteht aus einem Kohlenstoff- und einem Schwefelatom, welche durch eine Doppelbindung miteinander verbunden sind. Bei den Resten am Kohlenstoffatom der Thiocarbonylgruppe handelt es sich dabei um organische Reste (Alkylrest, Arylrest etc.). Thioketone sind ausnahmslos farbige Substanzen und zeichnen sich durch einen für organische Schwefelverbindungen typischen, intensiven Geruch aus.[2] Da ihre aliphatischen Monomere häufig instabil sind, tendieren sie zur Polymerisation. Dabei werden die Trimerisierungsprodukte bevorzugt gebildet.[3] Synthesen und Reaktionen von Thioketonen beziehen sich darum häufig auf stabilere, aromatische Thioketone.[4] Dennoch können heutzutage Thioketone jeder Art hergestellt werden.[5] NomenklaturZur Benennung von Thioketonen wird, wenn keine funktionelle Gruppen höherer Priorität vorhanden sind, das Präfix Thioxo- vor den Trivialnamen gestellt (z. B. Thioxoaceton, Thioxobenzophenon). Das Präfix Thio- ist gemäß der aktuellsten IUPAC-Nomenklatur veraltet, wird aber trotzdem häufig eingesetzt (z. B. Thioaceton, Thiobenzophenon). Wenn eine funktionelle Gruppe mit höherer Priorität vorliegt, wird das Suffix -thion angehängt (z. B. Cyclohexanthion). Deshalb werden Thioketone auch als Thione bezeichnet.[1] Eigenschaften  Physikalische EigenschaftenThioketone sind ausnahmslos farbige Verbindungen, wobei die erscheinenden Farben unterschiedlich sind.[3] Während niedere, aliphatische Thioketone häufig als rote Öle beobachtet wurden, erscheinen aromatische Thioketone blau bis violett (z. B.erscheint Thiobenzophenon blau). Bei der Trimerisierung von z. B. aliphatisch substituierten Thioketonen entstehen hingegen farblose Derivate von Trithian.[2] Thioketone stehen im Gleichgewicht zu ihren Ennthiolderivaten (vgl. Keto-Enol-Tautomerie), die Verschiebung des Gleichgewichts ist sowohl temperaturabhängig als auch abhängig vom Lösungsmittel, und hat einen Einfluss auf die Farbintensität (Thermochromie). Unterschiedliche Thioketone weisen unterschiedliche Tendenzen zur Enthiolosierung auf.[5] Der Geruch von Thioketonen wird oft als besonders unangenehm beschrieben. Sie lösen sich gut in unpolaren Lösungsmitteln.[7] Die Stabilität der Thioketone ist von den gebundenen Resten abhängig und unterscheidet sich stark: während monomere Thioketone instabil sind und darum leicht polymerisieren, werden aromatische Thioketone durch ihre Reste stabilisiert. Darum sind Diaryl- und hereocyclische Thioketone stabiler, gut kristallisierbar und weisen keine Tendenz zur Polymerisation auf. Ihr Geruch ist etwas weniger unangenehm.[2][7] Zudem hängt die Stabilität und damit ihre Reaktivität mit der photometrischen Reaktionsfähigkeit zusammen.[8] Chemische EigenschaftenObwohl Kohlenstoff und Schwefel in der charakteristischen C=S-Doppelbindung dieselbe Elektronegativität aufweisen, und die Doppelbindung darum als schwach polar aufgefasst werden könnte, ist sie leicht polarisierbar.[9] Das zeigt sich in ihrer Eigenschaft, als Dipolarophile in Cycloadditionsreaktionen zu reagieren.[10] Grundsätzlich reagieren Thiocarbonylverbindungen im Vergleich zu Carbonylverbindungen wesentlich schneller in Cycloadditionen.[11] Begründet durch die Festkörperstruktur können auch intramolekulare Diels-Alder-Reaktionen erfolgen.[12] Insgesamt handelt es sich um reaktionsfreudige Verbindungen, welche sowohl mit nucleophilen als auch in elektrophilen Reagenzien leicht umgesetzt werden können.[5] Die oben beschriebene Thioketo-Enthiol-Tautomerie hat erheblichen Einfluss auf die chemischen Eigenschaften von Thioketonen. Einige liegen, besonders in protischen Lösungsmitteln, nahezu vollständig als Enthiole vor. Andere bevorzugen den Zustand als Thioketon. Das ermöglicht vielfältige Reaktionen mit nucleophilen und mit elektrophilen Reagenzien (Kapitel: Reaktionen).[7] Zudem können Thioketone Komplexverbindungen mit Metallen der sechsten Nebengruppe bilden.[13] Die chemischen Eigenschaften α-β-ungesättigter Thioketone unterscheiden sich von den Eigenschaften gesättigter Thioketone. Das liegt zum einen an den konjugierten C=C- und C=S-Doppelbindungen, welche Thioketone solcher Art zu besonders reaktionsfreudigen Dienen in Diels-Alder-Reaktionen machen. Zum anderen ist die Tautomerisierung zu Enthiolen ausgeschlossen. Dieser Effekt wird durch elektronenschiebende Substituenten in β-Stellung begünstigt (mesomerer Effekt).[5] SyntheseDie Synthese von Thioketonen bereitet aufgrund der Instabilität der Monomere und des starken Geruchs Wissenschaftlern häufig Schwierigkeiten. Zunächst wurde angenommen, dass sich Thioketone durch die Pyrolyse der Trimere oder durch die Einwirkung von Schwefelwasserstoff auf Ketone im sauren Milieu gewinnen liesen.[14][15] Letztere Methode hat sich nur in Einzelfällen bewährt. Viele der in der Literatur zitierten Methoden haben den Nachteil, dass die Produkte unrein sind und anstatt von Thioketonen geminale Dithiole entstanden. Roland Mayer schlug daraufhin eine Synthese von Thioketonen aus geminalen Dithiolen vor:[7]  Dabei werden zwei Äquivalente des Dithiols mit Malonsäuredinitril umgesetzt, wobei unter Abspaltung eines Thioamids das entsprechende Thioketon gebildet wird.[5] Außerdem können arylsubstituierte, geminale Dichloride (Ketochloride) verwendet werden. Dieses, aus Ketonen leicht zugängliche Edukt, wird mit Kalium-O-ethyldithiocarbonat umgesetzt. Das entstehende Zwischenprodukt reagiert unter Abspaltung von Chlorethan und Carbonylsulfid zum entsprechenden Thioketon.[3][5][16]  Thiobenzophenon ist ein klassisches Beispiel für ein Thioketon. Bei beiden Resten handelt es sich um Arylreste, welche die Verbindung stabilisieren. Diese Stabilität macht das Thioketon handhabbar. Es kann auf unterschiedlichen Wegen synthetisiert werden, z. B. durch die Umsetzung von Benzophenon mit Schwefelwasserstoff und Salzsäure (Weg A), oder durch eine Schwefelvariante der Friedel-Crafts-Acylierung von Benzol mit einem Thiosäurechlorid (Weg B):[17][5]  Alternativ kann Thioessigsäure mit Ketochloriden umgesetzt werden, wobei unter Abspaltung von Salzsäure ebenfalls Thiobenzophenon gebildet wird. Der Vorteil dieser Variante besteht darin, dass sie nicht im alkoholischen Medium stattfindet, sodass Nebenreaktionen (welche auf der Reaktion zwischen Ketochchloriden und Alkoholen beruhen) ausgeschlossen sind.[7] Analog zur Synthese von Michlers Keton kann Michlers Thioketon durch die Reaktion von Thiophosgen mit N,N-Dimethylanilin gebildet werden. Das Zinkchlorid fungiert dabei als Lewis-Katalysator.[11] 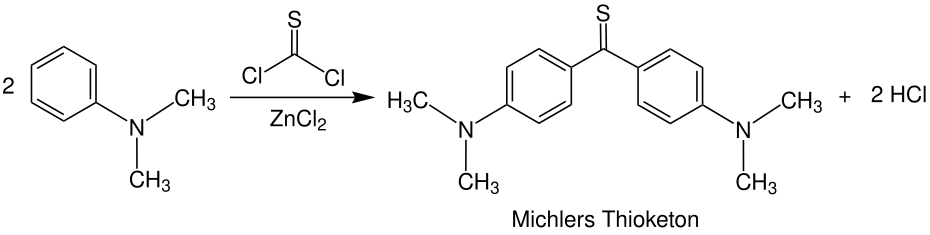 Heutzutage existieren jedoch effizientere Methoden zur Thionisierung. Diese beinhalten oft die Umsetzung von Ketonen mit Lawessons Reagenz. Andere Varianten setzen Ketone mit Phosphorpentasulfid um, wobei Aluminiumoxid als Katalysator fungiert.  Die Idee Phosphorpentasulfid als Reagenz zur Thioketonsynthese zu verwenden wurde früh vorgeschlagen und häufig als gutes Mittel zur Schwefelung von Ketonen beschrieben.[5] Der Zusatz von Aluminiumoxid ist eine moderne Variante, welche die Reaktion enorm beschleunigt und die Ausbeuten stark erhöht.[18] Darüber hinaus wurden weitere Methoden zur Herstellung von Thioketonen beschrieben.[19] Hierzu zählt die Synthese aus Alkinen mit Schwefelwasserstoff unter Lichteinwirkung, die Reaktion von Ketohydrazonen mit Dischwefeldichlorid oder durch die [3,3]-sigmatrope Thio-Claisen-Umlagerung von Allyl-vinyl-ethern.[5] ReaktionenVor allem aliphatische Thioketone neigen aufgrund von ihrer Reaktivität zur Trimerisierung.[2] Dabei werden substituierte 1,3,5-Trithiane gebildet. Die Derivate von 1,3,5-Trithian können in organischen Synthesen nützliche Zwischenprodukte darstellen.[20]  Die größten Unterschiede zwischen den Reaktionen von Thioketonen und Ketonen wurden bei der Reaktion mit Nucleophilen, Olefinen und konjugierten Dienen beobachtet. Während nucleophile Angriffe bei Carbonylverbindungen am Kohlenstoffatom der Carbonylgruppe erfolgen, können sie bei Thiocarbonylverbindungen sowohl am Kohlenstoff- als auch am Schwefelatom auftreten.[11] Mit Monoolefinen können Thioketone in En-Reaktionen zu acyclischen Verbindungen wie Thioethern oder zu Thiolen reagieren:  Cyclische Produkte können durch die Diels-Alder-Reaktion synthetisiert werden, indem z. B. ein konjugiertes Dien mit einem Thioketon zur Reaktion gebracht wird, wobei die C=S-Doppelbindung das Dienophil darstellt:  Auf diese Weise können heterocyclische Verbindungen synthetisiert werden. Cycloadditionsreaktionen laufen mit Thioketonen wesentlich schneller ab, als mit Ketonen.[11] Außerdem lassen sich durch diese Reaktion Dihydrothiopyrane herstellten.[21]
Heterocyclische Verbindungen können auch durch die Umsetzung von Thioketonen mit Diazomethan gewonnen werden. Dabei wird unter Abspaltung von Stickstoff (N2) ein dipolares Intermediat gebildet. Dieses kann erneut mit einem Thioketon umgesetzt werden, wobei durch Dimerisierung heterocyclische Verbindungen erhalten werden. Das Intermediat kann allerdings auch eine irreversible, intramolekulare Cycloaddition eingehen und Thiirane bilden.[22] Diese können in einem weiteren Reaktionsschritt in Alkene überführt werden.[9][23][24]  Des Weiteren können Thioketone oxidiert werden. Eine solche Oxidation führt zu Sulfinen, den S-Oxiden der Thioketone, und schließlich zu Sulfenen, den S,S-Dioxiden der Thioketone.[9] Die Bezeichnung Sulfine wurde von Sheppard und Diekmann geprägt, um die strukturelle Beziehung zu Sulfenen zum Ausdruck zu bringen.[25] Diese wurde hingegen eingeführt, um ihre Verwandtschaft mit Ketenen zu betonen.[26] Beide Bezeichnungen werden aus traditionellen Gründen verwendet. Sowohl die IUPAC als auch moderne Literatur empfiehlt die Bezeichnungen Thioketonoxid bzw. Thioketondioxid.[27] Während Sulfine früh als stabile Verbindungen dargestellt wurden, gelang dies mit Sulfenen relativ spät.[28][29] Letzteres ist in der Reaktivität von Sulfenen begründet, denn die Partialladungen der einzelnen Atome sind stärker ausgeprägt als bei Sulfinen, so dass elektrophile Angriffe auf das Kohlenstoffatom wesentlich leichter erfolgen können. Als Oxidationsmittel fungieren dabei meistens Wasserstoffperoxid oder Peroxycarbonsäuren, wobei Ozon oder Singulettsauerstoff in Einzelfällen ebenfalls eingesetzt wurden. Allerdings ist wichtig, dass der Sauerstoffüberträger nicht im Überschuss verwendet wird, weil Sulfine oxidationsempfindlich sind und darum leicht unter Abgabe von Schwefeldioxid zu den entsprechenden Carbonylverbindungen reagieren können.[4] Thioketone können auch mit organischen Aziden umgesetzt werden, wobei Imine als Zwischenprodukte gebildet werden. Wenn diese hydrolytisch gespalten werden, können Ketone und primäre Amine erhalten werden.[3]  ReaktionsübersichtDie Folgenden Tabellen zeigen eine Übersicht von Reaktionen der Thioketone mit einigen nucleophilen und elektrophilen Reagenzien. Aliphatische Thioketone reagieren mit Nucleophilen unter Eliminierung von Schwefelwasserstoff weitestgehend analog zu Ketonen. Mit elektrophilen Reagenzien reagieren nahezu alle Thioketone am Schwefelatom zu Derivaten von Enthiolen, was einige präparative Möglichkeiten eröffnet. Vereinzelt sind Reaktionen am α-Kohlenstoffatom ebenfalls möglich. Die Tabelle ist beispielhaft auf aliphatische, symmetrische Thioketone bezogen, die Reaktionen können auch mit asymmetrischen Thioketonen durchgeführt werden.[7]
Praktische BedeutungThioketone haben überwiegend präparative Bedeutung für Synthesen in der Organischen Chemie.[2][31] Organische Schwefelverbindungen bieten grundsätzlich nicht nur vielfältige, synthetische Möglichkeiten, sie spielen auch in biologischen Prozessen eine wichtige Rolle. Sie wurden bereits zur Herstellung von Pharmazeutika, Polymeren, Pestiziden und Herbiziden eingesetzt.[18] Für die Einführung von Schwefelatomen in Heterocyclen eignen sich Thioketone besonders gut.[11] Einzelnachweise
|