|
PyBOP
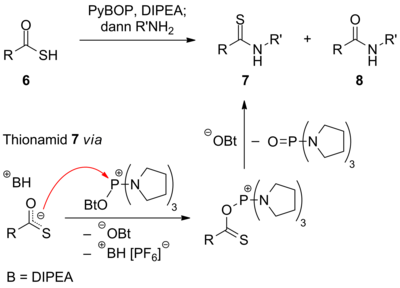
PyBOP (Benzotriazol-1-yl-oxytripyrrolidinophosphonium-hexafluorophosphat) zählt zu den organischen Phosphoniumsalzen und wird als Kupplungsreagenz in der Peptidsynthese eingesetzt. Diese von der Gruppe um Castro 1990 eingeführte[1] Verbindung stellt eine Weiterentwicklung des Phosphoniumsalzes BOP dar, welche nicht wie letztere hochgradig toxisches HMPT nach erfolgter Kupplung freisetzt. DarstellungDie ursprüngliche Synthese von PyBOP geht aus von Tripyrrolidinophosphinoxid, welches mittels Phosgen in das Chlorophosphoniumsalz überführt wird. Im Anschluss wird mit dem Triethylammoniumsalz des 1-Hydroxybenzotriazols (HOBt) umgesetzt, welches aus HOBt und Triethylamin (Et3N) zugänglich ist, wodurch ein Chlorid gegen OBt substituiert wird. Den letzten Schritt bildet der Austausch des Chlorid-Anions gegen ein schwach koordinierendes Hexafluorophosphat-Anion.[4] Anstelle von gasförmigem Phosgen kann auch festes Triphosgen[5], oder Phosphorylchlorid[1] eingesetzt werden. Das strukturverwandte BOP lässt sich ebenso über diesen Weg darstellen.[4] Im BOP sind lediglich die Pyrrolidino- bzw. Pyrrolidin-1-id- durch Dimethylamidgruppen substituiert. EigenschaftenDie Verbindung ist thermisch instabil. Eine DSC-Messung zeigt ab 121 °C eine sehr stark exotherme Zersetzungsreaktion mit einer Wärmetönung von −1020 kJ·kg−1 bzw. −530,8 kJ·mol−1.[6] VerwendungKupplungsreagenzPyBOP wird in der Peptidsynthese als Kupplungsreagenz eingesetzt. Hierbei wird die Aktivierung über das Phosphoniumsalz 2 oder den OBt-Aktivester 3 realisiert. Letzterer ist dafür bekannt, Racemisierung zu unterdrücken, reagiert aber auch langsamer mit einem Amin 4 zum Peptid bzw. allgemein zum Amid. Eine Triebkraft der Reaktion stellt die Bildung von stabilem Phosphorsäuretriamid 5 dar.[7] B steht in diesem Schema für Base. Meist wird PyBOP zusammen mit DIPEA eingesetzt. Andere ReaktionenMittels PyBOP lassen sich auch Thiolsäureester 6 mit Aminen verknüpfen, wobei jedoch neben dem Amid 8 das Thionamid 7 gebildet wird, wodurch ein einfacher Zugang zu dieser Stoffklasse geschaffen wird. Die typische Synthese von Thionamiden verläuft unter Reaktion eines Amids mit Lawessons Reagenz. Der Grund für die hier dargestellte O/S-Selektivität liegt in der stärkeren Bindung von Phosphor an Sauerstoff.[8] Durch Reaktion von Amiden mit PyBOP/DIPEA lassen sich Nitrile darstellen. Auch hier greift der Sauerstoff der Carbonylgruppe nucleophil das Phosphoratom des PyBOPs an. In Gegenwart von Base werden das Hexafluorophosphat-Anion, HOBt und das Phosphorsäuretriamid abgespalten. Die Abstraktion des Imin-Wasserstoffatoms kann durch das OBt-Anion (im Schema gezeigt) oder direkt durch die Base geschehen.[9] Einzelnachweise
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia