|
Mukaiyama-Aldolreaktion
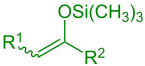
Die Mukaiyama-Aldolreaktion, auch Mukaiyama-Reaktion genannt, ist eine Namensreaktion der organischen Chemie und wurde in den frühen 1970er Jahren durch den japanischen Chemiker Teruaki Mukaiyama entdeckt.[1][2] Es handelt sich um eine Form der gekreuzten Aldolreaktion, die zu den wichtigsten Reaktionen zur Bildung von Kohlenstoff-Kohlenstoff-Bindungen zählt.[3] Die Mukaiyama-Aldolreaktion ist verwandt mit der Mukaiyama-Michael-Reaktion. ÜbersichtBei der Mukaiyama-Aldolreaktion werden silylierte Enole unter Anwesenheit einer Lewis-Säure an Carbonylverbindungen addiert. Die Reaktion lässt eine Vielzahl möglicher Reste zu (siehe Edukte).[3] Im einfachsten Fall (R2 = H) und ohne den Einsatz von chiralen Katalysatoren läuft die Reaktion wie folgt ab:  Es bildet sich bei der Reaktion ein Gemisch aus zwei Reaktionsprodukten, genauer ein Racemat. Werden Gemische aus cis- und trans-Isomeren der jeweiligen silierten Enole verwendet, entstehen vier Reaktionsprodukte:  Sowohl das syn-Diastereomer als auch anti-Diastereomer treten als Racemat auf. Ob sich bei der Reaktion bevorzugt das anti-Diastereomer oder das syn-Diastereomer bildet, hängt von den eingesetzten Edukten, Reagenzien sowie den vorherrschenden Reaktionsbedingungen ab. In der Originalarbeit wurden stöchiometrische Mengen von Lewis-Säuren, wie beispielsweise TiCl4, SnCl4 oder Ähnliche, verwendet.[2] In späteren Studien wurden jedoch verschiedene katalytische Versionen entwickelt. Dabei konnten sowohl verschiedene Lewis-Säuren als auch Lewis-Basen zur Durchführung der Reaktion verwendet werden.[1] MechanismusEin möglicher Mechanismus wird von László Kürti und Barbara Czakó in dem Buch Strategic Applications of Named Reactions in Organic Synthesis formuliert.[3] Der Übersichtlichkeit halber wird im Mechanismus nur die einfachere Variante für den Fall R2 = H gezeigt:  In dem vorliegenden Beispiel zum Reaktionsmechanismus wird die Lewis-Säure TiCl4 als Katalysator verwendet. Im ersten Reaktionsschritt wird die Carbonylgruppe des Aldehyds durch die zugesetzte Lewis-Säure aktiviert. Anschließend greift die Doppelbindung des Silans an der aktivierten Carbonylgruppe an und bildet eine neue Kohlenstoff-Kohlenstoff-Bindung aus. Unter Abspaltung eines Silylchlorids bildet sich die Reagenz 1. Durch Aufarbeitung, sprich Hydrolyse, erhält man ein racemisches Gemisch der Aldole 2 und 3.[3] AnwendungDer Reaktion kommt eine große Bedeutung in der modernen Synthesechemie zu. Durch den Einsatz chiraler Lewis-Säuren als Katalysator kann die Stereochemie besonders effektiv beeinflusst werden.[4] Unter Verwendung eines Enantiomers eines chiralen Katalysators, hier als L* gekennzeichnet, verläuft die Reaktion nach folgendem Reaktionsschema:  Eine der zahlreichen Anwendungen der Mukaiyama-Aldolreaktion findet sich beispielsweise in der Synthese des Naturstoffs Sphingofungin B.[3] Folgendes Reaktionsschema zeigt die Synthese eines wichtigen Zwischenprodukts in der Sphingofungin-B-Synthese:  Die Mukaiyama-Aldolreaktion wird hier vor allem aufgrund der exzellenten Stereoselektivität genutzt.[4] Unter Verwendung eines (S)-Prolin-Derivats als chiraler Ligand am Katalysator kann mit einer Ausbeute von 87 % und einem Enantiomerenüberschuss von 94 % das abgebildete Produkt synthetisiert werden. Hierbei steht die verwendete Abkürzung Tf für Triflat. Einzelnachweise
|
Portal di Ensiklopedia Dunia