|
Metallcarbonyle Metallcarbonyle sind Komplexverbindungen von Übergangsmetallen mit Kohlenstoffmonoxid als Ligand. Die Metalle treten in diesen Verbindungen mit der Oxidationszahl ±0 auf und weichen in ihren Eigenschaften zum Teil erheblich von den klassischen Metallverbindungen ab. Einkernige Metallcarbonyle mit nur einem Zentralatom sind oft gut in organischen Lösungsmitteln löslich und leichtflüchtig. Der Kohlenstoffmonoxidligand kann durch eine große Zahl von anderen Liganden ersetzt werden und führt so zu gemischten Metallcarbonylen. Die Verbindungen finden Verwendung in der organischen Synthese und als Katalysatoren oder Katalysatorvorstufen in der chemischen Industrie, etwa bei der Hydroformylierung und der Reppe-Chemie. Im Mond-Verfahren wird das Metallcarbonyl Nickeltetracarbonyl verwendet, um reines Nickel herzustellen. Metallcarbonyle dienen über die Substitution des Kohlenstoffmonoxidliganden, über Oxidations- und Reduktionsreaktionen am Metall oder durch nukleophilen Angriff am Carbonyl-Kohlenstoffatom als Vorstufen für andere Komplexverbindungen und zum Studium von Metall-Metall-Bindungen. Metallcarbonyle können durch Hautkontakt, Einatmen oder Verschlucken aufgenommen werden. Sie sind giftig und bewirken beim Einatmen eine schwere Schädigung der Lungen. Eine hohe Exposition kann zu einer toxischen Lungenentzündung oder zum toxischen Lungenödem führen. Giftig ist auch das Zerfallsprodukt Kohlenstoffmonoxid, das sich an Hämoglobin bindet und damit den Sauerstofftransport im Blut beeinträchtigt. NomenklaturDie Nomenklatur der Metallcarbonyle richtet sich nach der Ladung des Komplexes, der Anzahl und Art der Zentralatome und der Anzahl und Art der Liganden und deren Bindungsmodi. Metallcarbonyle treten in Form neutraler Komplexe, als positiv geladene Metallcarbonyl-Kationen oder als negativ geladene Metallcarbonylat-Anionen auf. Einkernige Metallcarbonyle enthalten nur ein einziges Metallatom als Zentralatom. Außer Vanadiumhexacarbonyl bilden nur Metalle gerader Ordnungszahl wie Chrom, Eisen, Nickel und deren Homologe neutrale, einkernige Komplexe. Mehrkernige Metallcarbonyle bilden sich aus Metallen mit ungerader Ordnungszahl und enthalten eine Metall-Metall-Bindung.[1] Komplexe mit unterschiedlichem Zentralatom, aber identischen Liganden in gleicher Anordnung, werden als isoleptisch bezeichnet.[1] Die Anzahl der Kohlenstoffmonoxidliganden in einem Metallcarbonylkomplex wird mit einem griechischen Zahlwort, gefolgt von dem Wort -carbonyl, benannt. Komplexe, die nur Kohlenstoffmonoxid als Ligand enthalten, werden als reine oder homoleptische Metallcarbonyle bezeichnet. Enthalten die Komplexe neben Kohlenstoffmonoxid noch andere Liganden, werden die Komplexe gemischte oder heteroleptische Metallcarbonyle genannt.[1] Kohlenstoffmonoxid weist in Metallcarbonylen verschiedene Bindungsmodi auf. Sie unterscheiden sich in der Haptizität und dem Verbrückungsmodus. Die Haptizität beschreibt die Anzahl der Kohlenstoffmonoxidmoleküle, die direkt an das Zentralatom gebunden sind. Die Benennung erfolgt durch den Buchstaben ηn, der dem Namen des Komplexes vorangestellt wird. Der hochgestellte Index n gibt die Anzahl der gebundenen Atome an. Bei Monohapto-Koordination, wie etwa bei terminal gebundenem Kohlenstoffmonoxid, ist die Haptizität 1 und es erfolgt meist keine gesonderte Benennung. Ist Kohlenstoffmonoxid sowohl über das Kohlenstoff- als auch über das Sauerstoffatom an das Metall gebunden, wird dies als Dihapto-Koordination η2 bezeichnet.[2] Der Verbrückungsmodus beschreibt die Anzahl der Metallatome, die von einem Ligandatom überbrückt werden. Die Benennung erfolgt mit dem Buchstaben μm. Der tiefgestellte Index m gibt die Anzahl der überbrückten Metallatome an. Bei zwei überbrückten Zentren wird der tiefgestellte Index mitunter nicht ausgeschrieben, sodass μ der Schreibweise μ2 entspricht. Kohlenstoffmonoxid tritt in den Komplexen terminal, verbrückend als μ2 und facial als μ3 und als Vier-Elektronen-Donor in einer μ3 als μ2-η2-Brücke auf.[3] Die Tendenz zur Brückenbildung des Kohlenstoffmonoxidliganden sinkt mit steigendem Atomradius des Zentralatoms. GeschichteFrühe Arbeiten Erste Versuche zur Umsetzung von Kohlenstoffmonoxid mit Metallen führte Justus von Liebig im Jahr 1834 durch. Durch Überleiten von Kohlenstoffmonoxid über geschmolzenes Kalium gelangte er zu einer Substanz mit der Summenformel KCO, die er Kohlenoxidkalium nannte.[4] Es handelt sich bei der dargestellten Verbindung jedoch nicht um ein Metallcarbonyl, sondern um das Kaliumsalz des Hexahydroxybenzols beziehungsweise um das Kaliumsalz des Dihydroxyacetylens.[5] Die Synthese des ersten echten heteroleptischen Metallcarbonyl-Komplexes gelang Paul Schützenberger im Jahre 1868. Durch Überleiten von Chlor und Kohlenstoffmonoxid über Platinmohr stellte er Dicarbonyldichloridoplatin dar.[6] Ludwig Mond, einer der Mitbegründer der Imperial Chemical Industries, untersuchte in den Jahren um 1890 zusammen mit Carl Langer und Friedrich Quincke verschiedene Verfahren zur Rückgewinnung des beim Solvay-Verfahren verlorengehenden Chlors mittels Nickelmetalls, -oxiden und -salzen.[5] Bei den Versuchen behandelten sie unter anderem Nickel mit Kohlenstoffmonoxid. Dabei stellten sie fest, dass das entstehende Gas die Gasflamme eines Bunsenbrenners grünlich-gelb färbte und beim Erhitzen im Glasrohr einen Nickelspiegel bildete. Das Gas ließ sich zu einer farblosen, wasserklaren Flüssigkeit mit einem Siedepunkt von 43 °C kondensieren. Damit hatte die Gruppe um Mond mit Nickeltetracarbonyl den ersten reinen homoleptischen Metallcarbonylkomplex entdeckt.[7] Die für eine Metallverbindung ungewöhnliche Leichtflüchtigkeit des Nickeltetracarbonyls bewog Lord Kelvin zu der Aussage, dass es Mond gelungen sei, „den Metallen Flügel zu geben“.[8] Im Jahr darauf berichtete Mond zeitgleich mit Marcelin Berthelot über die Darstellung von Eisenpentacarbonyl nach einem verwandten Verfahren. Mond erkannte das wirtschaftliche Potenzial dieser Verbindungsklasse, die er im Mond-Verfahren nutzte, und ließ in seinem Unternehmen weiter nach verwandten Verbindungen forschen. Seine Mitarbeiter Heinrich Hirtz und Matthewman Dalton Cowap stellten weitere Metallcarbonyle von Cobalt, Molybdän und Ruthenium sowie Dieisennonacarbonyl dar.[9] Die Strukturaufklärung des Dieisennonacarbonyls, das aus Eisenpentacarbonyl durch Einwirkung von Sonnenlicht entsteht, gelang erst James Dewar und H. O. Jones im Jahr 1906.[10] Nach dem Tod von Mond im Jahr 1909 geriet die Chemie der Metallcarbonyle einige Jahre in Vergessenheit. Die BASF nahm 1924 die großtechnische Produktion von Eisenpentacarbonyl nach einem Verfahren von Alwin Mittasch auf und verarbeitete es zu hochreinem Eisen, sogenanntem Carbonyleisen, und Eisenoxidpigment weiter.[11] Grundlagenforschung durch Walter HieberErst 1927 gelang André Job und A. Cassal mit der Darstellung von Chromhexacarbonyl und Wolframhexacarbonyl die Synthese weiterer homoleptischer Metallcarbonyle. Die Arbeiten von Walter Hieber leisteten in den darauffolgenden Jahren ab 1928 einen entscheidenden Beitrag zur Weiterentwicklung der Metallcarbonylchemie. Er untersuchte sie systematisch und entdeckte unter anderem die Hiebersche Basenreaktion, die zu den ersten bekannten Metallcarbonylhydriden führte und Synthesewege zu Metallcarbonylen wie Dirheniumdecacarbonyl eröffnete.[12] Hieber, der ab 1934 Direktor des Anorganisch-chemischen Instituts der Technischen Universität München war, veröffentlichte in vier Jahrzehnten 249 Arbeiten zur Metallcarbonylchemie.[5] Technische Verfahren nach Walter Reppe und Otto Roelen (heute: Max-Planck-Institut für Kohlenforschung) In den 1930er Jahren entdeckte Walter Reppe, ein Industriechemiker und späteres Vorstandsmitglied der BASF, eine Reihe homogenkatalytischer Verfahren, wie etwa die Hydrocarboxylierung zur Umsetzung von Olefinen oder Alkinen mit Kohlenstoffmonoxid und Wasser zu Produkten wie ungesättigten Carbonsäuren und deren Derivaten.[5] Bei diesen Reaktionen finden zum Beispiel Nickeltetracarbonyl oder Cobaltcarbonyle als Katalysatoren Verwendung.[13] Daneben gelang Reppe mit Metallcarbonylkatalysatoren die Cyclotrimerisierung und -tetramerisierung von Acetylen und seinen Derivaten zu Benzol und Benzolderivaten sowie Cyclooctatetraen. Die BASF baute in den 1960er Jahren eine Produktionsstätte für Acrylsäure nach dem Reppe-Verfahren. Erst 1996 verdrängten modernere Verfahren auf Basis der katalytischen Propylenoxidation den Prozess. Im Jahr 1938 entdeckte Otto Roelen am damaligen Kaiser-Wilhelm Institut für Kohlenforschung die Synthese von Fettalkoholen mittels homogenkatalytischer Hydroformylierung unter Verwendung von Cobaltcarbonylen. Dabei werden Olefine mit Kohlenstoffmonoxid und Wasserstoff großtechnisch zu Aldehyden und Alkoholen umgesetzt. Mittels Hydroformylierung durch modifizierte Metallcarbonyle im Ruhrchemie/Rhône-Poulenc-Verfahren werden bis heute jährlich mehrere Millionen Tonnen verschiedener Produkte hergestellt.[14] Arbeiten von E. O. FischerIm Jahr 1964 entdeckte E. O. Fischer, der bei Walter Hieber über Metallcarbonylchemie promoviert hatte, den ersten Carbenkomplex, indem er Wolframhexacarbonyl analog zur Hieberschen Basenreaktion mit Butyllithium umsetzte. Seine Arbeiten zeichnete die Königlich Schwedische Akademie der Wissenschaften im Jahr 1973 mit dem Nobelpreis für Chemie aus. Ein Gegenstand der metallorganischen Forschungen waren substituierte Metallcarbonyle, bei denen Kohlenstoffmonoxidliganden durch andere Liganden wie Phosphine oder Cyclopentadienylanionen (Halbsandwichkomplexe) ersetzt sind. Ein von Lauri Vaska synthetisierter gemischter Iridium-Carbonyl-Komplex (Vaskas Komplex) zeigt eine reversible Bindung von Sauerstoff und dient als Modellsubstanz für die Untersuchung des Sauerstofftransports im Blut. Rowland Pettit entdeckte 1965, dass Metallcarbonyle der Stabilisierung antiaromatischer Zustände dienen können.[15] Zunehmend Verwendung fanden Metallcarbonyle im Bereich der organischen Chemie. Im Jahr 1971 wurde die Pauson-Khand-Reaktion entdeckt, bei der Kohlenstoffmonoxid mit einem Olefin und einem Alkin zu substituierten Cyclopentenonen reagiert. Als Kohlenstoffmonoxidlieferant diente Dicobaltoctacarbonyl. Bereits 1973 gelang es, eine katalytische Variante des Verfahrens zu entwickeln.[16] Wolfgang A. Herrmann gelang 1982 durch Oxidation eines Kohlenstoffmonoxidliganden mit Trimethylaminoxid die Darstellung eines gemischten zweikernigen Metallcarbonylkomplexes, der eine Metall-Metall-Doppelbindung aufweist.[17] Molekülorbitaltheorie und Isolobalanalogie Die Struktur der Metallcarbonyle blieb lange Zeit Gegenstand von Spekulationen. Für Nickeltetracarbonyl wurde zunächst eine ionische Struktur mit einem Tetracarbonyldianion [C4O4]2− vermutet. Basierend auf dem Elektroneutralitätsprinzip schlug Irving Langmuir im Jahr 1921 eine Struktur mit Nickel-Kohlenstoff-Doppelbindung vor.[18] Arbeiten von Linus Pauling 1935 kamen zu dem Schluss, dass Nickeltetracarbonyl ein tetraedrischer Komplex mit Resonanzstrukturen mit Doppelbindungscharakter sei. Pauling gab den Doppelbindungscharakter der Nickel-Kohlenstoff-Bindung auf Grund der Bindungslänge von 182 pm mit 78 Prozent an.[19] Im Jahr 1981 erhielten Roald Hoffmann und Fukui Ken’ichi den Nobelpreis für Chemie für ihr Konzept der Molekülorbitaltheorie und der Isolobalanalogie, mit dem unter anderem die Strukturen und die Chemie von Metallcarbonylen elegant beschrieben werden können.[20] Moderne ForschungsrichtungenDer Ersatz des Kohlenstoffmonoxids durch maßgeschneiderte Liganden, etwa durch das wasserlösliche Tris(natrium-meta-sulfonatophenyl)phosphan, erlaubte die Herstellung gemischter Metallcarbonyle. Deren Eigenschaften konnten gezielt den Anforderungen technischer Prozesse angepasst werden. Komplexe dieser Art finden in großtechnischen Verfahren wie dem Ruhrchemie/Rhône-Poulenc-Verfahren zur industriellen Herstellung von Butanal aus Propen, Wasserstoff und Kohlenstoffmonoxid Verwendung. Im Jahr 2009 untersuchten Mediziner den Einsatz von Metallcarbonylen in der Krebstherapie, bei der durch lichtinduzierte Reduktion gezielt Kohlenstoffmonoxid freigesetzt wird, um Krebszellen kontrolliert abzutöten.[21][22] Vorkommen In der sauerstoffreichen irdischen Atmosphäre unterliegen Metallcarbonyle schnell der Oxidation zum Metalloxid. Es wird diskutiert, ob in reduzierenden hydrothermalen Umgebungen der präbiotischen Urzeit solche Komplexe entstanden und als Katalysatoren für die Synthese von kritischen biochemischen Verbindungen wie Brenztraubensäure zur Verfügung gestanden haben könnten.[23] Verschiedene Metallcarbonyle wie Eisen-, Nickel- und Wolframcarbonyl wurden als Spurenverunreinigung in den gasförmigen Ausdünstungen im Klärschlamm kommunaler Kläranlagen nachgewiesen.[24] Biologische Bedeutung haben kohlenstoffmonoxidhaltige Komplexe des Hämoglobins und des Myoglobins.[25] Hydrogenasen enthalten zum Teil an Eisen gebundenes Kohlenstoffmonoxid.[26] Neuere Forschungen identifizierten Eisenpentacarbonyl als eine möglicherweise treibende Kraft für Vulkanausbrüche und als Teil des Magmas auf terrestrischen Planeten und dem Mond. Darüber hinaus wird Eisenpentacarbonyl als Komponente planetarer Kohlenstoffkreisläufe gesehen.[27] Bei der Untersuchung des Infrarot-Spektrums des galaktischen Zentrums wiesen Astronomen Kohlenstoffmonoxid-Schwingungen von Eisencarbonylen in interstellaren Staubwolken nach.[28] Chinesische Forscher identifizierten Eisencarbonyl-Cluster in Jiange H5-Chondriten mittels Infrarotspektroskopie. Sie fanden vier Infrarot-Streckschwingungen, die sie terminalen und verbrückenden Kohlenstoffmonoxid-Liganden zuordneten.[29] HerstellungDie Stoffklasse der Metallcarbonyle ist vor allem seit den Arbeiten Hiebers Gegenstand intensiver metallorganischer Forschung. Seither entwickelten Chemiker viele Syntheseverfahren für die Darstellung von einkernigen Metallcarbonylen bis hin zu komplexen homo- und heterometallischen Clustern. Da diese Verbindungen zum Teil außerordentlich empfindlich gegenüber Luft, Licht, Feuchtigkeit und Temperatur sind, empfiehlt sich bei der Herstellung und Handhabung von Metallcarbonylen die Verwendung der Schlenk-Technik. Ferner etablierten sich Darstellungsmethoden unter Druck bis 500 bar in mit Silber oder Kupfer ausgekleideten Autoklaven.[5] Direkte Umsetzung von Metall mit KohlenstoffmonoxidNickeltetracarbonyl und Eisenpentacarbonyl können durch Umsetzung von fein verteiltem Metall mit Kohlenstoffmonoxid gemäß folgender Gleichungen hergestellt werden: Nickeltetracarbonyl bildet sich mit Kohlenstoffmonoxid bereits bei 80 °C und Normaldruck, feinverteiltes Eisen reagiert bei Temperaturen zwischen 150 und 200 °C und einem Kohlenstoffmonoxiddruck von 50 bis 200 bar.[11] Carbonyle anderer Metalle wie Molybdänhexacarbonyl, Rutheniumpentacarbonyl oder Cobaltoctacarbonyl lassen sich zwar auch auf diese Weise gewinnen, werden aber meist über andere Synthesewege hergestellt.[31] Reduktion von Metallsalzen und -oxidenEine weitere Möglichkeit der Darstellung von Metallcarbonylen besteht in der Reduktion von Metallhalogeniden mit einem Reduktionsmittel unter Kohlenmonoxiddruck. Als Reduktionsmittel dienen unter anderem metallisches Kupfer oder Aluminium, Wasserstoff, Kohlenstoffmonoxid oder Metallalkyle wie Triethylaluminium. In guter Ausbeute verläuft etwa die Darstellung von Chromhexacarbonyl aus wasserfreiem Chrom(III)-chlorid in Benzol mit Aluminium als Reduktionsmittel und Aluminiumchlorid als Katalysator: Wird Kohlenstoffmonoxid bei geeigneten Konditionen im Überschuss eingesetzt, fungiert es als Reduktionsmittel. Eine der ersten bekannten Synthesen nach diesem Verfahren gelang Walter Hieber und H. Fuchs mit der Darstellung von Dirheniumdecacarbonyl aus dem Oxid im Jahr 1941.[32] Beim Einsatz von Metalloxiden bildet sich als Oxidationsprodukt Kohlenstoffdioxid. Bei der Reduktion von Metallchloriden mit Kohlenstoffmonoxid entsteht Phosgen, etwa bei der Darstellung von Osmiumcarbonylchlorid aus dem Chlorid.[5] Kohlenstoffmonoxid eignet sich für die Reduktion von Sulfiden, wobei Carbonylsulfid entsteht. Beim Einsatz von Metallalkylen als Reduktionsmittel erfolgt eine oxidative Kupplung des Alkylrests zum Dimer. Als Metallalkyle eignen sich Triethylaluminium oder Diethylzink, die Umsetzung erfolgt in Diethylether als Lösungsmittel. Die Reduktion von Wolfram-, Molybdän-, Mangan- und Rhodiumsalzen ist mit Lithiumaluminiumhydrid als Reduktionsmittel in Diethylether möglich. Die Darstellung von Vanadiumhexacarbonyl gelingt mit Natrium als Reduktionsmittel in chelatisierenden Lösungsmitteln wie Diglyme.[33] In wässriger Phase lassen sich zum Beispiel Nickel- oder Cobaltsalze mit Natriumdithionit reduzieren. Unter Einwirkung von Kohlenstoffmonoxid bildet sich aus Cobaltsalzen quantitativ das Tetracarbonylcobaltat(-I) (Cobaltcarbonylat).[33] Photo- und Thermolyse Photolyse oder Thermolyse von einkernigen Carbonylen erzeugt die mit Metall-Metall-Bindungen ausgestatteten Carbonyle wie beispielsweise Dieisennonacarbonyl (Fe2(CO)9). Beim weiteren Erhitzen zerfallen die Komplexe letztendlich in das Metall und Kohlenstoffmonoxid. Die thermische Zersetzung von Triosmiumdodecacarbonyl (Os3(CO)12) liefert höherkernige Osmiumcarbonylcluster wie Os4(CO)13 über Os6(CO)18 bis zum Os8(CO)23.[33] Oxidation von MetallcarbonylanionenDas Dimere Ditantaldodecacarbonyl Ta2(CO)12 kann durch die Oxidation von einem Tantalhexacarbonylanion mittels einem Silbersalz erhalten werden.[34] SalzmetatheseDurch die Salzmetathese, zum Beispiel von KCo(CO)4 mit [Ru(CO)3Cl2]2, lassen sich gezielt gemischtmetallische Metallcarbonyle wie RuCo2(CO)11 darstellen.[35] Metallcarbonyl-Kationen und -carbonylateDie Darstellung ionischer Verbindungen ist durch Oxidation beziehungsweise Reduktion aus den Neutralkomplexen möglich. Die kationischen Hexacarbonylsalze des Mangans, Technetiums und Rheniums lassen sich aus den Carbonylhalogeniden unter Kohlenstoffmonoxiddruck durch Umsetzung mit einer Lewis-Säure darstellen. Durch die Verwendung von starken Säuren gelang die Darstellung von Goldcarbonylkationen wie [Au(CO)2]+, die als Katalysator für die Carbonylierung von Olefinen verwendet werden.[36] Der kationische Platincarbonylkomplex [Pt(CO)4]+ ist durch die Arbeit in sogenannten Supersäuren wie Antimonpentafluorid zugänglich. Metallcarbonylate sind beispielsweise durch Reduktion zweikerniger Komplexe mit Natrium erhältlich. Ein bekanntes Beispiel ist das Natriumsalz des Eisentetracarbonylats (Na2Fe(CO)4, Collmans Reagenz), das in der organischen Synthese für die Darstellung von Aldehyden durch Umsatz mit Alkylbromiden oder Säurehalogeniden angewendet wird. EigenschaftenPhysikalische EigenschaftenDie einkernigen Carbonylkomplexe der Metalle der achten Nebengruppe sind häufig farblose bis gelbliche Flüssigkeiten, die leicht flüchtig und hochgiftig sind. Die Dämpfe der Nickel- und Eisencarbonyle bilden mit Luft explosionsfähige Gemische.[33] Die Carbonyle der Metalle der sechsten Nebengruppe sind farblose Kristalle, die unter Zersetzung schmelzen. Vanadiumhexacarbonyl, ein 17-Elektronenkomplex, ist ein blauschwarzer Feststoff.[37] Die zweikernigen Metallcarbonyle der ersten Nebenperiode sind gelb bis orange, die der höheren Perioden sind farblos. Mehrkernige Metallcarbonyle sind gelbe, rote bis schwarze Kristalle; Trieisendodecacarbonyl (Fe3(CO)12) bildet tiefgrüne Kristalle. Die kristallinen Metallcarbonyle sind im Vakuum sublimierbar, teilweise unter Zersetzung.[37] Metallcarbonyle sind löslich in vielen organischen Lösungsmitteln wie Benzol, Diethylether, Aceton, Eisessig und Tetrachlorkohlenstoff, jedoch nicht in Wasser. In Mineralsäuren lösen sich Metallcarbonyle unter Gasentwicklung und der Bildung der Metallsalze.[11] Molekulare EigenschaftenBindung Metallcarbonyle werden durch die synergistischen σ-Donor/π-Akzeptor-Wechselwirkungen des Kohlenstoffmonoxids mit dem Metall besonders stabilisiert. Durch diese Wechselwirkungen wird die Elektronendichte vom gefüllten σ*-Orbital der C-O-Bindung, dem freien Elektronenpaar am C-Atom, in die symmetrieäquivalenten, leeren d-Orbitale des Metalls und von gefüllten Metallorbitalen in die leeren π*-Orbitale der C-O-Mehrfachbindung verschoben. Hierdurch erfährt der gesamte Komplex eine Elektronendelokalisierung und damit eine energetische Stabilisierung durch den nephelauxetischen Effekt. Es existiert ferner eine π-Donor-Wechselwirkung, die jedoch schwach ist und daher oft vernachlässigt wird. Nach Linus Pauling lässt sich die Struktur durch die Resonanz der folgenden Grenzstrukturen erklären. Strukturen kleiner Metallcarbonyle Die Strukturen der Metallcarbonyle werden in erster Linie durch das VSEPR-Modell und die 18-Elektronen-Regel, bei komplizierteren Strukturen mithilfe des Isolobalkonzepts vorhergesagt, für deren Entwicklung Roald Hoffmann den Nobelpreis erhielt. Dabei stellen Metallcarbonylfragmente M(CO)n Teile oktaedrischer Bausteine dar, die in Analogie zur organischen Chemie der tetraedrischen CH3-, CH2- oder CH-Fragmente kombinierbar sind. Im Beispiel des Dimangandecacarbonyls liegen im Sinne der Isolobalanalogie zwei d7Mn(CO)5-Fragmente vor, die isolobal zum Methylradikal CH3• sind. Diese lassen sich analog zur Kombination der Methylradikale zum Ethan zum Dimangandecacarbonyl kombinieren. Das Vorliegen von isolobalanalogen Fragmenten bedeutet nicht, dass sich die gewünschten Strukturen darstellen lassen. In seinem Nobelpreisvortrag betonte Hoffmann, dass die Isolobalanalogie ein nützliches, aber einfaches Modell sei und in bestimmten Fällen nicht zum Erfolg führt.[20] Komplexe mit Metallen höherer Perioden bilden im Vergleich zu denen niedrigerer Perioden bevorzugt weniger C-O-Brücken aus, was unter anderem auf die nach der Ligandenfeldtheorie größere Aufspaltung der Metall-Valenzorbitale und die damit verbundene low-spin-Konfiguration zurückzuführen ist.
Struktur von Metallcarbonylclustern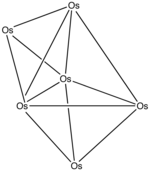 Cluster sind laut einer Definition von F. A. Cotton Moleküle, in denen zwei oder mehr Metallatome außer an andere Nichtmetallatome auch an sich selbst gebunden sind:
Je nach Größe der betrachteten Cluster werden verschiedene Ansätze angewendet, um die Strukturen zu beschreiben. Kleine Cluster mit zwei bis sechs Metallgerüstatomen befolgen mit wenigen Ausnahmen die 18-Elektronenregel (EAN, Effective Atomic Number Rule, Sidgwick Rule). Die Strukturen größerer Cluster mit etwa fünf bis zwölf Gerüstatomen lassen sich anhand modifizierter Wade-Regeln, den sogenannten Wade-Mingos-Regeln (Skelett-Elektronenpaar-Theorie), vorhersagen. Nach den Isolobalregeln werden dabei die Komplexfragmente in isolobale Borhydrideinheiten überführt.
Besonders große Metallcarbonylcluster mit mehr als zwölf Gerüstatomen haben bereits dominant metallischen Charakter, sodass sie eher als metallische Mikrokristallite mit chemisorbiertem Kohlenstoffmonoxid zu beschreiben sind. Die Struktur entspricht einem Ausschnitt aus dem Metallgitter. Chemische EigenschaftenMit wenigen Ausnahmen erfüllen die Metallcarbonyle die 18-Elektronen-Regel. Die Regel besagt, dass Komplexe mit 18 Valenzelektronen stabil sind, da die Metalle damit die Elektronenzahl des nächsthöheren Edelgases erreichen.[42] Die Regel lässt sich auf viele Komplexe der Übergangsmetalle anwenden. Metallcarbonyle stellen wichtige Ausgangsverbindungen für die Darstellung anderer Komplexe dar. Die wichtigsten Reaktionen sind die Substitution des Kohlenstoffmonoxids durch andere Liganden, die Oxidation und Reduktion des Metalls sowie Reaktionen am Kohlenstoffmonoxid. Die Substitution in 18-Elektronen-Komplexen erfolgt durch einen dissoziativen Mechanismus über eine 16-Elektronen-Stufe. Die Substitution kann thermisch oder photochemisch induziert werden. Bei der photochemisch induzierten Substitution wird durch Lichtabsorption ein antibindendes Molekülorbital des Komplexes besetzt, wodurch die Metall-Kohlenstoff-Bindung geschwächt und der Ligand abgespalten wird. Bei Metallcarbonylclustern, deren Metall-Metall-Bindungen durch Licht gespalten werden können, kann die Substitution durch Oxidation eines Kohlenstoffmonoxidliganden zu Kohlenstoffdioxid mit einem Oxidationsmittel wie Trimethylaminoxid eingeleitet werden. Der Kohlenstoffmonoxidligand lässt sich oft leicht durch analoge Liganden wie zum Beispiel Phosphane, Cyanid-Ion (CN−), Olefine oder das Nitrosyl-Kation (NO+) substituieren. Die Reaktion wird vorteilhaft in Lösungsmitteln wie Diethylether oder Acetonitril durchgeführt, welche die entstehenden Zwischenstufen als den Sauerstoff- beziehungsweise Stickstoffdonorliganden stabilisieren können. Konjugierte Olefine können pro olefinischer Doppelbindung einen Kohlenstoffmonoxidliganden im Komplex ersetzen. Die Dissoziationsenergie beträgt 105 kJ·mol−1 für Nickeltetracarbonyl und 155 kJ·mol−1 für Chromhexacarbonyl.[37] Die Substitution in 17-Elektronen-Komplexen erfolgt nach einem assoziativen Mechanismus über eine 19-Elektronenstufe. Die Reaktionsgeschwindigkeit nach dem assoziativen Mechanismus ist in vielen Fällen gegenüber dem dissoziativen Mechanismus erhöht. Vanadiumhexacarbonyl reagiert etwa um den Faktor 1010 schneller als Wolframhexacarbonyl. Mittels Elektronentransferkatalyse, etwa durch katalytische Oxidation eines 18-Elektronenkomplexes zum 17-Elektronenkomplex, lässt sich die Substitutionsgeschwindigkeit in 18-Elektronenkomplexen erheblich erhöhen.[43] Mit Reduktionsmitteln wie metallischem Natrium in Ammoniak bilden die Metallcarbonyle Metallcarbonylat-Anionen. Dabei kann es bei mehrkernigen Komplexen zur Spaltung der Metall-Metall-Bindung kommen. Bei der Hieberschen Basenreaktion reagiert das Hydroxid-Ion mit Metallcarbonylen wie Eisenpentacarbonyl durch nukleophilen Angriff am Carbonyl-Kohlenstoffatom unter Freisetzung von Kohlenstoffdioxid und Bildung von Metallcarbonylaten. In einem weiteren Schritt lässt sich Eisencarbonylhydrid, ein sehr temperatur- und luftempfindliches Komplexhydrid, synthetisieren, das Walter Hieber 1931 entdeckte: Durch die Hiebersche Basenreaktion sind Metallcarbonylhydride wie beispielsweise Cobaltcarbonylhydrid (HCo(CO)4) zugänglich. Analog zur Hieberschen Basenreaktion reagieren Organolithium-Verbindungen mit Metallcarbonylen. Durch anschließende Alkylierung mit dem Meerwein-Salz Trimethyloxoniumtetrafluoroborat werden Fischer-Carbene erhalten. 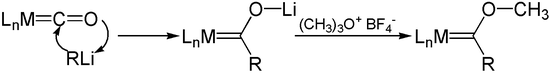 Mit Halogenen reagieren Metallcarbonyle unter oxidativer Halogenierung. Bei mehrkernigen Komplexen kann es dabei zur oxidativen Spaltung von Metall-Metall-Bindungen kommen. Ungesättigte Verbindungen oder Quecksilber können in die Metall-Metall-Bindung von mehrkernigen Metallcarbonylen insertieren. Natriumtetracarbonylferrat, als Collmans Reagenz bekannt, wird in der organischen Synthese zur Darstellung von Aldehyden aus Alkylbromiden verwendet. Im ersten Schritt reagiert das Anion mit Alkylbromiden unter Bildung von Natriumbromid und dem Alkylkomplex. Durch Zugabe von Triphenylphosphan und anschließende Ansäuerung mit Essigsäure wird der Aldehyd freigesetzt. Der primär entstehende Alkylkomplex kann durch Triphenylphosphan in den Acylkomplex und durch Oxidation mit Sauerstoff und anschließender Ansäuerung in die Carbonsäure überführt werden. Durch Oxidation mit Halogenen wird der Acylkomplex in die Carbonsäurechloride überführt. Lewis-Säuren wie Trialkylaluminiumkomplexe können an den Sauerstoff des Kohlenstoffmonoxidliganden binden. Der Sauerstoff wirkt in diesem Fall als Lewis-Base.[44] VerwendungIn technischen Prozessen, bei denen kohlenstoffmonoxidhaltige Gase unter Druck verwendet werden, kann bei unsachgemäßer Materialauswahl regelmäßig die Bildung von Metallcarbonylen beobachtet werden, verbunden mit der Korrosion durch Bildung von Eisen- und Nickelcarbonylen.[11] So wurde früher bei der Verwendung von kohlenstoffmonoxidhaltigem Steinkohlengas ein rotbrauner, eisenhaltiger Belag auf Glühstrümpfen beobachtet, der aus der Oxidation von im Gas enthaltenem Eisencarbonyl stammte und die Leuchtkraft reduzierte.[11] Bei heterogenkatalytischen Prozessen wird eine Deaktivierung des Kontaktes infolge irreversibler Zersetzung von Metallcarbonylen auf der Kontaktoberfläche beobachtet. Für die Aufbewahrung von kohlenstoffmonoxidhaltigen Prüfgasen empfiehlt sich die Verwendung von Aluminiumflaschen, um die Bildung von Eisenpentacarbonyl zu vermeiden.[45] Mond-Verfahren Das Mond-Verfahren besteht aus drei Schritten. Im ersten Schritt wird Nickeloxid mit Synthesegas bei 200 °C umgesetzt, um das Oxid zum Metall zu reduzieren. Das unreine Nickel wird mit überschüssigem Kohlenstoffmonoxid in der kühleren Zone einer Transportapparatur bei 50–60 °C umgesetzt, um Nickeltetracarbonyl zu bilden.[46] Verunreinigungen wie Eisen und Cobalt bleiben als Feststoffe zurück. Die Mischung von überschüssigem Kohlenmonoxid und Nickeltetracarbonyl wird danach auf 220–250 °C erhitzt, wobei sich das Nickeltetracarbonyl zu metallischem Nickel und Kohlenstoffmonoxid zersetzt. Im Jahr 1910 stellte die Mond Nickel Company Ltd. bereits 3000 Tonnen Nickel mit einer Reinheit von 99,9 Prozent her. Das Verfahren wird bis heute angewendet, wobei allein in Nordamerika etwa 30.000 Tonnen pro Jahr hergestellt werden.[47] Die Zersetzung kann gezielt gesteuert werden, um entweder Nickelpulver zu erzeugen oder um ein bestehendes Substrat mit Nickel zu beschichten. Neben der Produktion von reinem Nickel eignet sich dieser Prozess auch für die Beschichtung von anderen Metallen mit Nickel. CarbonyleisenNach einem ähnlichen Verfahren wird Eisenpentacarbonyl zur Herstellung von Carbonyleisen genutzt, einem hochreinen Metallpulver, das unter anderem für die Herstellung von Spulenkernen, Diamantwerkzeugen, Pigmenten, als Nahrungsergänzungsmittel[48] sowie bei der Herstellung Radar-absorbierender Materialien in der Tarnkappentechnik[49] und im Metallspritzguss genutzt wird. Für die Herstellung von weichmagnetischen Spulenkernen werden meist die Carbonyleisenpartikel in einer isolierenden Kunststoffmatrix gebunden.[50] Dadurch werden besonders bei hohen Frequenzen die Wirbelströme verringert. Hydroformylierung (1) Eliminierung eines CO unter Bildung einer 16-Elektronen-Spezies. (2) Aufnahme des Olefins in freie Koordinationsstelle. (3) Bildung des 16-Elektronen-Alkylkomplexes durch Umlagerung. (4) Aufnahme von CO in freie Koordinationsstelle. (5) Insertion in die Metall-Kohlenstoff-Bindung des Alkylrestes unter Bildung eines 16-Elektronen-Acylkomplexes. (6) Oxidative Addition von Wasserstoff. (6) Freisetzung des Aldehyds, Wiederherstellung der aktiven Spezies. (7) Unter Bildung des Ausgangskomplexes schließt sich der katalytische Kreislauf. (8) Als Nebenreaktion kann der 16-Elektronen-Komplex in einer Gleichgewichtsreaktion ein Molekül Kohlenstoffmonoxid aufnehmen. Otto Roelen entdeckte 1938 die Hydroformylierung mit Cobaltcarbonylhydrid als aktiver Katalysatorspezies. Sie dient zur großtechnischen Synthese von Fettalkoholen, die zur Waschmittelherstellung genutzt werden. Heutzutage werden mehrere Millionen Tonnen Oxo-Produkte durch diesen Prozess gewonnen. Die Hydroformylierung zählt zu den atomökonomisch günstigen Verfahren, besonders wenn die Reaktion mit hoher Regioselektivität verläuft. Die aktiveren gemischten Rhodiumcarbonylhydride verdrängten die ursprünglich im Oxo-Prozess eingesetzten Cobaltcarbonylhydride.[51] Reppe-ChemieUnter Reppe-Chemie wird das Arbeiten mit Acetylen unter erhöhtem Druck verstanden, wobei Metallcarbonyle und -carbonylwasserstoffe als Katalysator Verwendung finden.[52] Eine wichtige Reaktionen ist die Hydrocarboxylierung, am Beispiel der Acrylsäure- und Acrylsäureester-Herstellung: Die Cyclisierung und die cyclisierende Polymerisation am Beispiel Benzol- und Cyclooctatetraen-Herstellung nutzt Metallcarbonyle als Katalysator:[53] Durch die Cotrimerisierung von Blausäure mit Acetylen lassen sich Pyridin und seine Derivate herstellen. Aus der Reppe-Chemie ergeben sich zahlreiche Zwischenprodukte der industriellen Chemie, die als Ausgangsprodukte für Lacke, Klebstoffe, Spritzgussmassen, Schaumstoffe, Textilfasern oder Medikamente in weiteren Verfahrensschritten dienen. Kohlenstoffmonoxidfreisetzende MoleküleKohlenstoffmonoxid besitzt eine biologische Wirkung als Botenstoff, das der Mensch in Mengen von etwa 3–6 cm³ pro Tag produziert. Entzündungen und Zustände, die die Hämolyse der roten Blutkörperchen beeinflussen, können die Menge wesentlich erhöhen. Kohlenstoffmonoxid besitzt entzündungshemmende Aktivität im Herz-Kreislauf-System und schützt das Gewebe vor Minderdurchblutung und Apoptose.[54] Kohlenstoffmonoxidfreisetzende Moleküle sind chemische Verbindungen, die Kohlenstoffmonoxid in zellulärer Umgebung freisetzen und so als therapeutisches Mittel wirken. Modifizierte Metallcarbonylkomplexe wie Acyloxybutadien-Eisencarbonyl-Komplexe oder der Ruthenium(II)-Komplex Ru(gly)Cl(CO)3 setzen im Organismus Kohlenstoffmonoxid frei und zeigen ähnliche biologische Wirkungen wie das Kohlenstoffmonoxid selbst.[55][56] Andere VerwendungenEisenpentacarbonyl katalysiert die Wassergas-Shift-Reaktion[57][58] nach folgendem Mechanismus:[59] Das Verfahren besitzt keine technische Bedeutung. Walter Ostwald, der Sohn Wilhelm Ostwalds, setzte Eisenpentacarbonyl als Antiklopfmittel in Benzin, dem sogenannten Motalin, ein.[60] Aufgrund von Ablagerungen von Eisenoxiden im Motorraum und an den Zündkerzen und von den damit verbundenen Problemen stellten die Raffinerien diese Verwendung jedoch ein. Bei der Gewinnung von reinem Wasserstoff aus Synthesegas wird die Bildung von Kupfercarbonylen in der letzten Stufe der Kohlenstoffmonoxidabtrennung genutzt.[5] Dazu wird das vorgereinigte Synthesegas durch eine kupferchloridhaltige wässrige Lösung geleitet, in der sich Kohlenstoffmonoxid unter Bildung eines Kupfercarbonyls ([(H2O)2ClCuCO]) bindet. Die thermische Zersetzung von Metallcarbonylclustern auf Trägermaterialien dient zur Herstellung von Kontakten mit definierter Metallteilchengröße, die in der heterogenen Katalyse Verwendung finden.[61] Neben der Abscheidung auf katalytisch aktiven Oberflächen wird die Umwandlung mononuklearer Komplexe in Metallcarbonylcluster in den Hohlräumen von Zeolithen untersucht.[62] Verwandte VerbindungenViele zum Kohlenstoffmonoxid isoelektronische Liganden bilden homoleptische Analoga zu den Metallcarbonylen oder heteroleptische Carbonylkomplexe. Triphenylphosphin-Liganden sind in weiten Grenzen variierbar und lassen sich durch Substitution in ihren Eigenschaften für verschiedene Anwendungen maßschneidern. PhosphankomplexeIn allen Metallcarbonylen können die Kohlenstoffmonoxidliganden durch Organophosphorliganden des Typs PR3 ganz oder teilweise substituiert werden. So ist zum Beispiel die Serie Fe(CO)5-x(PR3)x für bis zu drei Phosphinliganden bekannt.[63] Phosphortrifluorid (PF3) verhält sich ähnlich und bildet homoleptische Analoga der Metallcarbonyle, so zum Beispiel die flüchtigen stabilen Komplexe Fe(PF3)5 und Co2(PF3)8.[64] NitrosylkomplexeNitrosylverbindungen mit Stickstoffmonoxid (NO) als Ligand sind zahlreich, obwohl homoleptische Derivate nicht bekannt sind. Bezogen auf Kohlenstoffmonoxid ist Stickstoffmonoxid ein stärkerer Akzeptor. Bekannte Nitrosyl-Carbonyl-Komplexe sind CoNO(CO)3 und Fe(NO)2(CO)2.[65] ThiocarbonylkomplexeKomplexe mit Kohlenstoffmonosulfid (CS) sind bekannt, aber selten.[66] Dass solche Komplexe schwer darzustellen sind, ist zum Teil auf die Tatsache zurückzuführen, dass Kohlenstoffmonosulfid instabil ist. Somit erfordert die Synthese von Thiocarbonylkomplexen spezielle Synthesewege, wie etwa die Reaktion von Natriumtetracarbonylferrat mit Thiophosgen: Die analogen Komplexe von Kohlenstoffmonoselenid und Kohlenstoffmonotellurid sind sehr selten.[66] IsonitrilkomplexeIsonitrile bilden umfangreiche Familien von mit den Metallcarbonylen verwandten Komplexen. Typische Isonitrilliganden sind Methylisocyanid und tert-Butylisocyanid. Ein besonderer Fall ist Trifluormethylisocyanid (CF3NC), ein instabiles Molekül, das stabile Komplexe bildet, deren Verhalten dem der Metallcarbonyle ähnelt.[63] ToxikologieDie Toxizität eines Metallcarbonyls ist bedingt durch Giftigkeit des Kohlenmonoxids und des Metalls sowie der Volatilität und Instabilität des Komplexes. Die Exposition erfolgt durch Inhalation, bei flüssigen Metallcarbonylen durch Verschlucken oder, bedingt durch die gute Fettlöslichkeit, durch Hautresorption. Die meisten toxikologischen Erfahrungen stammen aus Vergiftungen mit Nickeltetracarbonyl und Eisenpentacarbonyl.[67] Nickeltetracarbonyl gilt als eines der stärksten Inhalationsgifte.[68] Das Einatmen von Nickeltetracarbonyl verursacht akut nichtspezifische Symptome ähnlich einer Kohlenmonoxidvergiftung wie Übelkeit, Reizhusten, Kopfschmerzen, Fieber und Schwindelgefühl. Nach einiger Zeit treten schwere pulmonale Symptome auf, wie Husten, Tachykardie, Zyanose, oder Probleme im Verdauungstrakt. Zusätzlich zu pathologischen Veränderungen der Lunge, etwa durch Metallierung der Lungenbläschen, und des Gehirns werden Schädigungen der Leber, der Nieren, der Nebennieren und der Milz beobachtet. Eine Metallcarbonylvergiftung bedingt häufig eine langanhaltende Rekonvaleszenz.[69] Eine chronische Exposition durch Einatmen geringer Konzentrationen von Nickeltetracarbonyl kann neurologische Symptome wie Schlaflosigkeit, Kopfschmerzen, Schwindel und Gedächtnisverlust verursachen.[69] Nickeltetracarbonyl gilt als krebserregend, wobei zwischen dem Beginn der Exposition und der klinischen Manifestation der Krebserkrankung 20 bis 30 Jahre liegen können.[70] Analytische Charakterisierung Wichtige analytische Techniken für die Untersuchung und Charakterisierung von Metallcarbonylen sind die Infrarotspektroskopie und die 13C-NMR-Spektrospkopie. Die Informationen, die diese beiden Techniken liefern, bewegen sich auf verschiedenen Zeitskalen. Infrarotaktive Molekülschwingungen wie C-O-Streckschwingungen sind oft schnell gegenüber intramolekularen Prozessen, während NMR-Übergänge langsamer sind und sich im Zeitbereich von intra- oder intermolekularen Ligandenaustauschprozessen abspielen. Dies kann dazu führen, dass NMR-Daten zeitgemittelte Informationen liefern.[37] Beispielsweise liefert die Untersuchung von Dicobaltoctacarbonyl (Co2(CO)8) mittels Infrarotspektroskopie Banden für 13 verschiedene CO-Schwingungen und damit erheblich mehr, als für 8 Substituenten zu erwarten ist. Der Grund liegt im gleichzeitigen Vorliegen von verschiedenen Isomeren, etwa mit und ohne verbrückenden CO-Liganden. Die 13C-NMR-Untersuchung der gleichen Substanz liefert dagegen sogar nur ein einziges Signal bei einer chemischen Verschiebung von 204 ppm. Dies indiziert, dass die Isomere sich schnell ineinander umwandeln. Infrarotspektroskopie Die Untersuchung von Metallcarbonylen mittels Infrarotspektroskopie liefert vielfältige Informationen, etwa über die Bindungsmodi des Kohlenstoffmonoxids, die Komplexgeometrie und die Ladung des Komplexes. Bei heteroleptischen Metallcarbonylen liefert die Infrarotspektroskopie außerdem Informationen über die Eigenschaften und Bindungsverhältnisse des zum Kohlenstoffmonoxid transständigen Liganden. Die Wellenzahl der C-O-Streckschwingung νCO des freien Kohlenstoffmonoxids liegt bei 2143 cm−1, die Anzahl und die Art der C-O-Valenzschwingung der Metallcarbonyle lassen einen Rückschluss auf die Struktur des Komplexes zu. Bei Metallcarbonylaten etwa bedingt die formale negative Ladung am Metall eine verstärkte Rückbindung in die anti-bindenden Orbitale des Kohlenstoffmonoxidliganden und damit eine Schwächung der Kohlenstoff-Sauerstoff-Bindung, die sich in solchen Komplexen in einer Verschiebung der Infrarotabsorption zu niedrigeren Wellenzahlen auswirkt. Kationische Komplexe verschieben diese entsprechend zu höheren Wellenzahlen. Außer den CO-Valenzschwingungen sind im beobachteten Wellenzahlbereich von circa 1800 bis 2000 cm−1 keine weiteren Schwingungen zu erwarten. Mittels Infrarotspektroskopie lassen sich terminale und verbrückende Liganden im Komplex unterscheiden.
Außer der Frequenz lässt die Anzahl der Schwingungsbanden einen Rückschluss auf die räumliche Struktur des Komplexes zu. Die Zahl der Schwingungsmoden eines Metallcarbonylkomplexes kann mittels Gruppentheorie bestimmt werden. Nur Schwingungsmoden, die mit einer Änderung des Dipolmoments einhergehen, sind infrarotaktiv und können beobachtet werden. Die Zahl der beobachtbaren IR-Übergänge, nicht aber deren Energien, kann somit vorhergesagt werden.[71][72][73] Oktaedrische Komplexe wie Cr(CO)6 weisen aufgrund der chemischen Übereinstimmung aller Liganden nur eine einzelne νCO-Bande im Infrarotspektrum auf. Spektren von Komplexen mit niedrigerer Symmetrie sind dagegen komplexer. Das Infrarotspektrum des Dieisennonacarbonlys Fe2(CO)9 weist beispielsweise C-O-Banden bei 2082, 2019 und 1829 cm−1 auf. Bei mehrkernigen Komplexen lässt die Lage der νCO-Schwingung einen Rückschluss auf die Koordinationsgeometrie des Kohlenstoffmonoxids zu. Für verbrückende μ2-koordinierende Liganden ist die Lage der νCO-Schwingung um etwa 100 bis 200 cm−1 zu niedrigeren Wellenzahlen gegenüber der νCO-Schwingung von Kohlenmonoxid in terminaler Position verschoben. Dieser Effekt ist für μ3-verbrückendes Kohlenstoffmonoxid noch ausgeprägter. Typische Werte für Rhodiumcluster sind:[74]
Kernspinresonanzspektroskopie Eine nützliche Methode zur Untersuchung von Metallcarbonylen ist die Kernspinresonanzspektroskopie von Kohlenstoffkernen wie 13C, Sauerstoffkernen wie 17O oder Metallkernen wie 195Pt, in gemischten Carbonylkomplexen von Phosphorkernen 31P und Wasserstoffkernen 1H.[75] Zur Verbesserung der Auflösung kommen bei der 13C-NMR-Spektroskopie Komplexe mit künstlich angereicherten 13C-Kohlenstoffmonoxidliganden zum Einsatz. Typische Werte der chemischen Verschiebung liegen für terminal gebundene Liganden bei 150 bis 220 ppm, für verbrückende Liganden bei 230 bis 280 ppm.[76] Die Abschirmung steigt mit der Ordnungszahl des Zentralatoms. Die Kernspinresonanzspektroskopie eignet sich zur experimentellen Bestimmung von Phänomenen der Komplexdynamik.[37] Aus der Messung der Temperaturabhängigkeit von Ligandenplatzwechseln lässt sich deren Aktivierungsenergie bestimmen.[77] Eisenpentacarbonyl zum Beispiel liefert nur ein einzelnes 13C-NMR-Signal. Der Grund liegt im schnellen Ligandenplatzwechsel durch Berry-Pseudorotation.[78] MassenspektrometrieDie Untersuchung von Metallcarbonylen mittels Massenspektrometrie lässt Rückschlüsse auf die Struktur der Komplexe zu. Die dabei meistverwandte Ionisationstechnik ist die Elektrospray-Ionisation (ESI). Dabei werden Lösungen geladener Substanzen versprüht, ionisiert und die Tröpfchen getrocknet, sodass Ionen des Analyten zurückbleiben. Diese Methode ist besonders geeignet für ionische Metallcarbonyle. Neutrale Metallcarbonyle können mittels Derivatisierung, etwa durch Umsetzung mit Alkoholaten, in ionische Spezies überführt werden. Durch die Reaktion der Metallcarbonyle mit Aziden entstehen unter Stickstofffreisetzung ionische Isocyanatderivate.[79] Metallcarbonyle ergeben leicht interpretierbare Spektren, da der dominierende Fragmentierungsprozess der Verlust der Carbonylliganden ist. Bei der Elektrospray-Ionisation-Massenspektrometrie ist die Fragmentierung der Komplexe durch Einstellen der Spannung variierbar. Somit lassen sich sowohl die molare Masse des Ursprungskomplexes ermitteln als auch Informationen über die strukturellen Umlagerungen von Clusterkernen, die unter thermolytischen Bedingungen ihre Kohlenstoffmonoxidliganden partiell oder vollständig verlieren.[80] Andere Verfahren wie die Matrix-unterstützte Laser-Desorption/Ionisation (MALDI), die sich für die Massenspektrometrie von hochmolekularen Stoffen bewährt hatten, liefern bei der massenspektrometrischen Untersuchung von Metallcarbonylen nur wenige brauchbare Informationen. Die untersuchten Verbindungen, etwa der Iridiumcarbonylcluster Ir4(CO)12, bildeten unter den Untersuchungsbedingungen Cluster mit bis zu 24 Iridium- und 30 bis 35 Carbonylliganden, wobei der Molekülionpeak nicht detektiert wurde.[79] Literatur
WeblinksCommons: Metallcarbonyle – Sammlung von Bildern, Videos und Audiodateien
Wiktionary: metal carbonyl – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen (englisch)
Einzelnachweise
|






![{\displaystyle \mathrm {VCl_{3}\ +\ 4\ Na\ +\ 6\ CO\ +\ Diglyme\ {\xrightarrow {(200\ bar,433\ K,48\ h)}}\ Na(digly)_{2}[V(CO)_{6}]\ +\ 3\ NaCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f5f7993bf93aa3793befa5340cbf66ddae1bd7f5)
![{\displaystyle \mathrm {2\ [V(CO)_{6}]^{-}\ +\ 2\ H^{+}\ \longrightarrow \ 2\ H[V(CO)_{6}]\ \longrightarrow \ 2\ V(CO)_{6}\ +\ H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/d805c317a8861eed563c81735eb146f67559475a)
![{\displaystyle \mathrm {2\ Co^{2+}\ +\ 3\ {S_{2}O_{4}^{2-}\ +\ 12\ OH^{-}\ +\ 8\ CO\longrightarrow \ 2\ [Co(CO)_{4}]^{-}\ +\ 6\ {SO_{3}}^{2-}\ +\ 6\ H_{2}O}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/34d938bf59609b29f6d11d3275184bd31354cbb9)

![{\displaystyle \mathrm {2\ [N(C_{2}H_{5})_{4}][Ta(CO)_{6}]\ +2\ Ag[AlOC(CF_{3})_{4}]\longrightarrow \ Ta_{2}(CO)_{12}\ +2\ Ag\ +2\ [N(C_{2}H_{5})_{4}][AlOC(CF_{3})_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/eda0b92314f19b434862f96542e57297934b1bd1)
![{\displaystyle \mathrm {4\ KCo(CO)_{4}\ +\ [Ru(CO)_{3}Cl_{2}]_{2}\ \longrightarrow \ 2\ RuCo_{2}(CO)_{11}\ +\ 4\ KCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8f6b7c98e4224cfd3dcba32d970dbd28f42d87a7)
![{\displaystyle \mathrm {Mn(CO)_{5}Cl\ +\ AlCl_{3}\ +\ CO\ \longrightarrow \ [Mn(CO)_{6}]^{+}\ [AlCl_{4}]^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/177d362e6ea0bcc96a1a59d06dd67d1e77b1db6c)







![{\displaystyle \mathrm {Me(CO)_{n}{\xrightarrow {-CO}}\ [Me(CO)_{n-1}]{\xrightarrow {+PPh_{3}}}\ Me(CO)_{n-1}PPh_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6b25cf52f5825db4d2561dfff516df015be473a)
![{\displaystyle \mathrm {Me(CO)_{n}{\xrightarrow {+PPh_{3}}}\ [Me(CO)_{n}PPh_{3}]{\xrightarrow {-CO}}\ Me(CO)_{n-1}PPh_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9085c4f584685973386d65c914e1db20d1e8ce4e)
![{\displaystyle \mathrm {Mn_{2}(CO)_{10}\ +\ 2\ Na\ \longrightarrow \ 2\ Na[Mn(CO)_{5}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ecfb565d54ae0af2389987c4c8bb83d490f924ea)
![{\displaystyle \mathrm {(1)\ Fe(CO)_{5}\ +\ NaOH\ \longrightarrow \ Na[Fe(CO)_{4}COOH]\ {\xrightarrow {+NaOH}}\ Na[HFe(CO)_{4}]\ +\ NaHCO_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ffabccef29d19fcca6ebec2ee72c99bc83788bb7)
![{\displaystyle \mathrm {(2)\ Na[HFe(CO)_{4}]\ +\ NaOH\ \longrightarrow \ Na_{2}[Fe(CO)_{4}]\ +\ H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6f64581546366efcc506c7c20d862d6b24b912fb)
![{\displaystyle \mathrm {Na[HFe(CO)_{4}]\ +\ H^{+}\ \longrightarrow \ H_{2}[Fe(CO)_{4}]\ +\ Na^{+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/28fab82b222f1df4b116024301618c23ce64306a)
![{\displaystyle \mathrm {Mn_{2}(CO)_{10}\ +\ Cl_{2}\ \longrightarrow \ 2\ [Mn(CO)_{4}Cl]\ +\ 2\ CO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8e9b48dd9a943be3c2a82a96f3e83d282fbc8d82)

![{\displaystyle \mathrm {Na_{2}[Fe(CO)_{4}]+RBr\ \rightarrow \ Na[RFe(CO)_{4}]+NaBr} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c17ec033f2db0a43121f950cc3d68de79b055bb8)
![{\displaystyle \mathrm {Na[RFe(CO)_{4}]+PPh_{3}\ \rightarrow \ Na[R(CO)Fe(CO)_{3}PPh_{3}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e931b224b933cb8afe457a720ca282ded5739058)







