|
Humane Adenoviren
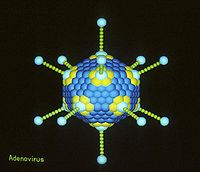
Humane Adenoviren (HAdV) sind humanpathogene Viren aus der Familie Adenoviridae und der Gattung Mastadenovirus. Sieben der 45 Arten dieser Gattung (Stand International Committee on Taxonomy of Viruses (ICTV), November 2018) können beim Menschen Erkrankungen auslösen und wurden erstmals 1953 von Wallace P. Rowe und anderen als Krankheitserreger für respiratorische Infektionen nachgewiesen[2] und aus menschlichen Rachenmandeln (Adenoiden) isoliert, wovon sich auch ihr Name ableitet. (Diese Viren und andere Adenoviridae, die in der Kultur in adenoidem Gewebe nekrotische Veränderungen verursachen, wurden früher auch als AD-Agens, von englisch Adenoid Degeneration Agents, genannt.[3]) Derzeit sind über 50 serologisch unterscheidbare Subtypen festgestellt. MerkmaleDie humanpathogenen Adenoviren gehören zu den unbehüllten doppelsträngigen, linearen DNA-Viren (dsDNA), daher zeichnen sie sich durch hohe Stabilität gegenüber chemischen und physikalischen Einwirkungen aus und tolerieren extreme pH-Werte und alkoholische Desinfektionsmittel. Zehnminütiges Erwärmen auf 56 °C inaktiviert sie hingegen vollständig. Ihr stabiles ikosaedrisches Kapsid und das Fehlen einer empfindlichen Hülle führt zu einer langanhaltenden Infektiosität außerhalb des Wirtskörpers. HAdVs haben einen Durchmesser von rund 70–90 nm. Die Größe des Genoms ist mit 26 bis 45 Kilobasenpaaren im mittleren Bereich der DNA-Viren[4].
KlinikAdenoviren verursachen hauptsächlich Erkrankungen der Atemwege. Abhängig vom jeweiligen Serotyp können allerdings auch eine Reihe anderer Erkrankungen hervorgerufen werden, so beispielsweise Gastroenteritis, Keratoconjunctivitis epidemica, Zystitis, Rhinitis, Pharyngitis oder Durchfälle. Die Symptome der Atemwegserkrankung durch Adenoviren reichen von der einfachen Erkältung über die akute Bronchitis bis zur Pneumonie. Bei Patienten mit geschwächtem Immunsystem besteht eine besondere Anfälligkeit für ernsthafte Komplikationen bei Adenovirus-Infektionen, wie zum Beispiel das Acute Respiratory Distress Syndrome (ARDS). Außerdem wird vermutet, dass es einen Zusammenhang zwischen dem Virustyp Ad-36 und Adipositas beim Menschen gibt. Ferner gibt es Hinweise darauf, dass Adenoviren beim Menschen eine Hirnvenenthrombose auslösen können[5][6]. EpidemiologieObwohl die epidemiologischen Merkmale der Adenoviren von Typ zu Typ verschieden sind, werden doch alle durch direkten Kontakt, fäkal-orale und gelegentlich durch Wasserübertragung weitergegeben. Einige Arten verursachen persistente, asymptomatische Infektionen von Hals- und Rachenmandeln oder Magen-Darm-Trakt des Wirtes; eine Ausbreitung kann über Monate oder Jahre erfolgen. Wenige Adenoviren (beispielsweise die Serotypen 1, 2, 5 und 6: Humanes Mastadenovirus C, HAdV-2) sind nachgewiesenermaßen in einigen Zonen der Welt endemisch; die Infektion erfolgt hier in der Regel bereits in der Kindheit. Andere Arten verursachen bei ansonsten sporadischen Infektionen gelegentliche Ausbrüche. So wird zum Beispiel die Keratoconjunctivitis epidemica durch die Serotypen 8, 19 und 37 (Humanes Mastadenovirus D, HAdV-9) ausgelöst. Epidemisch auftretende fieberhafte Erkrankungen mit Konjunktivitis sind oftmals mit Adenoviren assoziiert und treten im Allgemeinen im Umfeld unzureichend chlorierter Schwimmbecken und kleiner Seen auf. Gastroenteritiden werden, insbesondere bei Kindern, durch die Serotypen 40 und 41 (Humanes Mastadenovirus F, HAdV-40) ausgelöst. Bei einigen Serotypen variiert das klinische Spektrum der infektionsassoziierten Erkrankungen abhängig von der Eintrittspforte. So geht beispielsweise eine Infektion mit Serotyp 7 (Humanes Mastadenovirus B, HAdV-3) durch Inhalation mit schwerwiegenden Erkrankungen der unteren Atemwege einher, während eine orale Übertragung des Virus keine beziehungsweise nur eine milde Infektion verursacht. DiagnoseAntigen-Detektion, PCR-Assay, Virusisolation, Elektronenmikroskopie und Serologie dienen zum Nachweis von Adenovirus-Infektionen. Die Typbestimmung wird in der Regel durch Hämagglutinationshemmungsreaktion oder Neutralisation mit typspezifischen Antisera vorgenommen. Da Adenoviren über einen längeren Zeitraum ausgeschieden werden können, bedeutet der Nachweis des Virus nicht unbedingt auch den Nachweis einer Erkrankung. TherapieDie meisten Infektionen verlaufen mild und erfordern keine Therapie oder eine symptomatische Behandlung. Aber auch bei ernsthaften Erkrankungen durch Adenovirus-Infektionen richtet sich die Behandlung mangels virusspezifischer Therapie auf die Symptome und Komplikationen der Infektion. PräventionFür die Serotypen 4 und 7 wurden Adenovirusimpfstoffe entwickelt, die allerdings nur zur Prävention schwerer Atemwegsinfektionen bei Rekruten der US-Streitkräfte verfügbar sind. Für die effektive Beschränkung der Ausbreitung Adenovirus-assoziierter Erkrankungen, wie zum Beispiel die epidemische Keratokonjunktivitis, die 2004 die vorübergehende Schließung mehrerer Bundeswehr-Stützpunkte bedingte, ist eine sorgfältige Infektionskontrolle notwendig. SpätkomplikationenDiskutiert werden verschiedene Krankheitsbilder, die sich als Spätfolgen einer Adenoviren-Infektion einstellen können, wie beispielsweise die persistierende Bronchiolitis, Gelenkschmerzen, die dilatative Kardiomyopathie oder Hörsturz. Vielfach wurde bislang angenommen, dass auch Adenoviren als Auslöser für Typ-1-Diabetes galten, was sich aber 2013 durch die Ergebnisse der internationalen TEDDY-Studie (The Environmental Determinants of Diabetes in the Young) als relativ unwahrscheinlich herausstellte.[7] Anwendung von Adenoviren in der MedizinHumane Adenoviren (vor allem Typ 5 aus der Spezies C) sind ein im Labor weit verbreiteter Vektor. Sie finden vermehrt Einsatz in der Medizin für Gentherapie und Impfstoffe. Beispiele:
Forschung
MeldepflichtDie Meldepflicht von Adenoviren nur aus Konjunktivalabstrich unterliegt in Deutschland dem § 7 IfSG. Nach dem Recht Sachsens[14] ist der direkte oder indirekte Nachweis eines Astrovirus namentlich meldepflichtig, soweit der Nachweis auf eine akute Infektion hinweist. Weblinks
Einzelnachweise
|