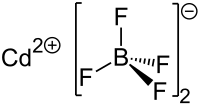
| Strukturformel
|
|
| Allgemeines
|
| Name
|
Cadmiumtetrafluoroborat
|
| Summenformel
|
Cd[BF4]2
|
| Externe Identifikatoren/Datenbanken
|
|
|
| Eigenschaften
|
| Molare Masse
|
286,02 g·mol−1
|
| Dichte
|
1,6 g·cm−3[1]
|
| Sicherheitshinweise
|
|
|
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa).
|
Cadmiumtetrafluoroborat ist eine anorganische chemische Verbindung des Bors aus der Gruppe der Tetrafluoroborate. Es ist kommerziell als 50%ige Lösung erhältlich.[4]
Gewinnung und Darstellung
Cadmiumtetrafluoroborat kann durch Reaktion von Tetrafluoroborsäure mit Cadmium, Cadmiumcarbonat[5] oder Cadmiumoxid gewonnen werden.
![{\displaystyle \mathrm {CdO+2\ H[BF_{4}]\rightarrow Cd[BF_{4}]_{2}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cf388d7f67873a15e63f986db58e6824a3f1a09d)
![{\displaystyle \mathrm {CdCO_{3}+2\ H[BF_{4}]\rightarrow Cd[BF_{4}]_{2}+CO_{2}\uparrow } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f848212a5462ac7a09ed14a7067db22d5559c55)
Eigenschaften
Cadmiumtetrafluoroborat kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pbca (Raumgruppen-Nr. 61)Vorlage:Raumgruppe/61 mit den Gitterparametern a=9,1271, b=8,746 und c=13,225 Å und acht Formeleinheiten in der Elementarzelle.[6] Cd[BF4]2 bildet Hydrate mit 2, 3 oder 6 Wassermolekülen. Alle Hydrate sind feste Salze.[7]
Verwendung
Cadmiumtetrafluoroborat wird zur Herstellung von galvanischen Bädern für hochfeste Stähle verwendet, wo normale Cyanidbäder zu Problemen mit der Wasserstoffversprödung führen.[8]
Einzelnachweise
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 95th Edition. CRC Press, 2014, ISBN 978-1-4822-0868-9, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Cadmiumverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. März 2019. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Cadmiumverbindungen, mit Ausnahme von Cadmiumselenosulfid (xCdS.yCdSe) und Reaction mass von Cadmiumsulfid und Zinksulfid (xCdS.yZnS), Reaction mass von Cadmiumsulfid und Quecksilbersulfid (xCdS·yHgS) sowie der Cadmiumverbindungen, die in diesem Anhang gesondert aufgeführt sind im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 23. März 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Apollo: Cadmium(II) tetrafluoroborate, 50 % aqueous solution, abgerufen am: 27. Dezember 2023
- ↑ A. K. Jain, M. Geoffroy: ESR study of phase transitions in single crystals of Cd(BF4)2, 6H2O. In: Solid State Communications. Band 40, Nr. 1, 1981, S. 33–35, doi:10.1016/0038-1098(81)90705-5.
- ↑ G. Tavčar, B. Žemva: XeF2 as a Ligand in a Coordination Compound with the BF4− Anion. In: Inorganic Chemistry, 2005, 44, S. 1525–1529, doi:10.1021/ic048684p.
- ↑ M. P. Georgiev, M. Maneva: Thermal decomposition and kinetic data of Cd(BF4)2-6H2O. In: Journal of Thermal Analysis. 47, 1996, S. 1729, doi:10.1007/BF01980918.
- ↑ Electroplating, Anodizing & Metal Treatment Hand Book. NIIR Project Consultancy Services, 2003, ISBN 81-7833-138-1, S. 131 (eingeschränkte Vorschau in der Google-Buchsuche).



![{\displaystyle \mathrm {CdO+2\ H[BF_{4}]\rightarrow Cd[BF_{4}]_{2}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cf388d7f67873a15e63f986db58e6824a3f1a09d)
![{\displaystyle \mathrm {CdCO_{3}+2\ H[BF_{4}]\rightarrow Cd[BF_{4}]_{2}+CO_{2}\uparrow } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f848212a5462ac7a09ed14a7067db22d5559c55)