|
Brookharts Säure
Brookharts Säure bezeichnet das Salz des Diethylether-Oxoniumions und Tetrakis[3,5-bis(trifluormethyl)phenyl]borat (BArF4). Es handelt sich um einen farblosen Feststoff und wird als starke Säure genutzt. Die erste Beschreibung der Substanz erfolgte durch Volpe, Grant und Brookhart 1992.[3] DarstellungDie Darstellung erfolgt durch Behandlung von NaBArF4 in Diethylether mit Chlorwasserstoff:
Während NaBArF4 in Diethylether löslich ist, ist dies bei Natriumchlorid nicht der Fall, weshalb das Ausfallen von selbigem das Reaktionsgleichgewicht in Richtung der Oxoniumsäure verschiebt. Diese kann als Feststoff isoliert werden.[3] Struktur und Eigenschaften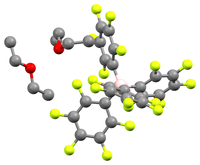 Die Säure kristallisiert als farbloser, hygroskopischer Feststoff. NMR und Elementaranalyse zeigen, dass die Kristalle zwei Äquivalente Diethylether enthalten. In Lösung zerfällt die Substanz langsam in m-C6H3(CF3)2 und BArF3.[3] [H(OEt2)2][B(C6F5)4] ist eine verwandte Verbindung mit einem ebenfalls schwach koordinierendem Anion, die 2000 publiziert wurde. Eine Röntgenstrukturanalyse der Verbindung konnte zeigen, dass das saure Proton von den zwei etherischen Sauerstoffatomen koordiniert wird, auch wenn der Kristall nicht gut genug war, dass man weiß, ob das Proton symmetrisch oder asymmetrisch sitzt.[4] VerwendungNormalerweise neigen schwach koordinierende Anionen wie Perchlorat, Tetrafluoroborat und Hexafluorophosphat dazu, an sehr elektrophile Kationen zu koordinieren, was sie in manchen Komplexen als Gegenionen unbrauchbar macht.[5] Die hochreaktive Spezies [Cp2Zr(CH3)]+ kann beispielsweise ein Fluoridanion von PF6 abstrahieren.[6] Aus diesem Grund wurde in den 1980er Jahren begonnen, neue schwach koordinierende Anionen zu entwickeln. BArF4-Anionen werden dabei als Gegenionen für hoch elektrophile, kationische Übergangsmetallspezies verwendet, da sie kaum koordinieren und gegenüber elektrophilen Angriffen unreaktiv sind.[3] Eine gebräuchliche Methode zur Synthese dieser kationischen Spezies ist die Protonolyse eines Dialkyl- oder Olefinkomplexes. Der elektrophile Palladiumkatalysator [(2,2′-bipyridin)Pd(CH3)(CH3CN)][BArF4] wird beispielsweise durch Protonierung der Dimethylverbindung mittels Brookharts Säure gewonnen. Die elektrophile, kationische Palladiumspezies wird wiederum für die Polymerisierung von Olefinen mit Kohlenstoffmonoxid zu Polyketonen in aprotischen Lösungsmitteln verwendet.[1] Potentielle Anwendungen Polyketone, eine Gruppe von thermoplastischen Polymeren,[7][8] werden durch die Copolymerisation von Kohlenstoffmonoxid mit einem oder mehreren Alkenen (typischerweise Ethylen oder Propylen) gebildet. Dafür werden Palladium(II) Katalysatoren mit einem bidentaten Liganden wie 2,2´-Bipyridin oder 1,10-Phenantrolin (phen) und einem nichtkoordinierenden BArF-Gegenion verwendet, beispielsweise [(phen)Pd(CH3)(CO)][BArF4].[1] Die Darstellung des Katalysators beinhaltet die Reaktion eines Dimethylpalladiumkomplexes mit Brookharts Säure in Acetonitril, wodurch Methan abgespalten wird. In einem zweiten Schritt wird das Acetonitril durch Kohlenstoffmonoxid ersetzt.[1]
Der Mechanismus beinhaltet eine Insertionsreaktion,[1] in welcher die Polymerkette an das katalytische Zentrum gebunden ist und durch sequentielle Insertion von Kohlenstoffmonoxid und dem Alken zwischen das Palladiumatom und die bestehende Kette wächst. Fehlstellen (in der unteren Abbildung mit rot markiert) treten auf, wenn die Insertion nicht alterniert, also einer Kohlenstoffmonoxidinsertion eine Alkeninsertion oder einer Alkeninsertion eine Kohlenstoffmonoxidinsertion folgt. Der oben genannte Katalysator führt nur zu wenigen Fehlstellen, da die Differenz in der Gibbs-Energie für die Insertion eines Alkens direkt nach einem Alken mit ungefähr 12 kJ/mol deutlich höher als für die Insertion von Kohlenstoffmonoxid liegt.[9]  Die Verwendung monodentater Phosphanliganden führt dabei zu unerwünschten Nebenprodukten[10], bidentate Phosphanliganden wie 1,3-Bis(diphenylphosphino)propan wurden allerdings schon industriell genutzt. Einzelnachweise
|
||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia
