|
Azomethin-Ylide Azomethin-Ylide sind stickstoffhaltige 1,3-Dipole, welche aus einem Iminium und einem Carbanion bestehen. Sie werden in 1,3-dipolaren Cycloadditionen verwendet. So können Heterocyclen, wie Pyrrolidine oder Pyrroline aufgebaut werden.[1][2][3] Diese Reaktionen sind hoch stereo- und regioselektiv und besitzen das Potential vier zusammenhängende Stereozentren zu generieren. Azomethin-Ylide haben dadurch großen Nutzen in der Totalsynthese sowie der Herstellung von chiralen Liganden und Medikamenten. Azomethin-Ylide können aus verschiedenen Verbindungen, wie Aziridinen, Iminen und Iminium-Ionen hergestellt werden. Meist erfolgt die Herstellung in situ mit anschließender Reaktion mit einem Dipolarophil. StrukturDie Resonanzstruktur zeigt die 1,3-Dipol-Beiträge, in denen die an den Stickstoff gebundenen Kohlenstoffe eine Ladung tragen.[1] Die häufigste Darstellung von Azomethin-Yliden zeigt den Stickstoff mit einer positiven Ladung, die negative Ladung wird über die Kohlenstoffatome verteilt. Die tatsächliche Ladungsverteilung ist abhängig von den Substituenten an den jeweiligen Atomen. Kohlenstoffe mit elektronenziehenden Gruppen tragen auf Grund der Stabilisierung eine höhere negative Partialladung.  Azomethin-Ylide können in drei verschiedenen Formen (engl. shape) vorliegen, die die stereochemie der 1,3-dipolaren Cycloaddition bestimmen. Ylide können W-förmig (W-shaped), U-förmig (U-shaped) und S-förmig (S-shaped) sein.[1] Die W- und U-förmigen Ylide, in denen die Substituenten in die gleiche Richtung zeigen, führen zu syn-Produkten, während S-förmige Ylide zu anti-Produkten führen. Die Position des Substituenten R3 ist abhängig von sterischen und elektronischen Aspekten. Die Stereochemie von R1 und R2 im Produkt wird durch den Dipol bestimmt. Die Stereochemie von R3 resultiert aus der Art des Dipolarophils. Falls das Dipolarophil mehr als monosubstituiert und prochiral ist, können vier neue Stereozentren aufgebaut werden.  HerstellungAus AziridinenAzomethin-Ylide können durch Ringöffnung von Aziridinen generiert werden.[4][5] In Einklang mit den Woodward-Hoffmann-Regeln findet die thermische 4-Elektronen Ringöffnung in einem konrotatorischen Prozess statt, während die photochemische Reaktion disrotatorisch abläuft.  Für asymmetrische Aziridine ändert sich je nach Substituent die Torquoselektivität. Elektronegative Substituenten präferieren eine Rotation nach außen, während elektropositive Substituenten eher nach innen rotieren.[6] Die Ringöffnung von Aziridinen kann neben dem Azomethin-Ylid auch einen anderen 1,3-Dipol liefern, wenn nicht die C-C-Bindung, sondern eine C-N-Bindung gebrochen wird.[7] Durch Kondensation von Aldehyden mit Aminen Eine der einfachsten Methoden Azomethin-Ylide zu generieren, besteht darin einen Aldehyd mit einem Amin einer Kondensation zu unterwerfen. Trägt das Amin am alpha-Kohlenstoff eine elektronenziehende Gruppe, wie einen Ester, kann einfach deprotoniert werden. Nachteil dieser Methode ist, dass sich die elektronenziehende Gruppe auch im Produkt der Cycloaddition wiederfindet. Alternativ zum Ester kann eine Carboxygruppe genutzt werden, die während der Cycloaddition durch Decarboxylierung entfernt werden kann.[8] Aus Iminen und Iminium-Salzen Azomethin-Ylide können durch direkte Deprotonierung von Iminium-Kationen gewonnen werden. Durch N-Metallierung Bei dieser Methode koordiniert ein Metall am Stickstoff und aktiviert so das Substrat. Verwendet werden unter anderem LiBr und AgOAc.[1] MünchnoneMünchnone sind mesoionische Heterocyclen, welche als Azomethin-Ylide fungieren können.[9] 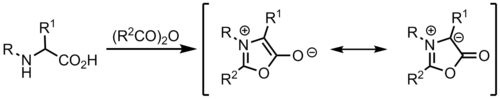 1,3-Dipolare Cycloadditionen Die 1,3-dipolare Cycloaddition mit Azomethin-Yliden ist ein 6-Elektronen Prozess. Gemäß der Woodward-Hoffmann-Regeln ist die Addition sowohl im Bezug auf den Dipol, als auch auf das Dipolarophil suprafacial. Die Reaktion wird generell als konzertiert angesehen, beide Kohlenstoff-Bindungen werden zur gleichen Zeit gebildet, jedoch asynchron. Je nach Natur des Dipols und des Dipolarophils sind aber auch diradikalische oder zwitterionische Intermediate möglich.[10] Wie auch in der isoelektronischen Diels-Alder-Reaktion ist das endo-Produkt favorisiert. In dieser Reaktion reagiert das HOMO des Ylides und das LUMO des elektronendefizitären Dipolarophils. Jedoch sind auch Reaktionen mit unaktivierten π-Systemen bekannt, vor allem, wenn es sich um eine intramolekulare Cyclisierung handelt.[11]  In 1,3-dipolaren Cycloadditionen von Azomethin-Yliden werden meist Alkene oder Alkine als Dipolarophil verwendet. Dabei entstehen Pyrrolidine oder Pyrroline.[12] Als Dipolarophil werden meist α,β-ungesättigte Carbonyle eingesetzt, andere funktionelle Gruppen sind Teil der aktuellen Forschung.[13] Sind Dipol und Dipolarophil Teil des gleichen Moleküls, so kann die intramolekulare Reaktion zu Polycyclen mit hoher Komplexität führen.[1] Ist das Dipolarophil mit einem Kohlenstoff des Dipols verknüpft, so entsteht ein annelierter Bicyclus. Ist das Dipolarophil an den Stickstoff gebunden, so entsteht eine überbrückte Struktur. Intramolekulare Varianten haben den Vorteil, dass die Regioselektivität häufig eingeschränkt ist. Ein weiterer Vorteil ist, dass bei intramolekularen Varianten das Dipolarophil nicht elektronenarm sein muss, es sind Varianten mit elektronenreichen, alkylsubstituierten Dipolarophilen bekannt. Stereoselektivität der CycloadditionWährend die meisten Dipole in Cycloadditionen ihre Stereoinformation verlieren, sind Azomethin-Ylide in der Lage ihr Stereochemie beizubehalten. Dies wird meist durch Öffnen eines Aziridins und anschließendes abfangen (trapping) durch ein Dipolarophil erreicht. So kann die Stereochemie das Ylides sich nicht ändern. Wie in anderen 1,3-dipolaren Cycloadditionen können endo- und exo-Produkte entstehen. Die Selektivität kann durch Metallkatalyse verändert werden.[14][15] Enantioselektive SyntheseEnantioselektive Cycloadditionen von Azomethin-Yliden durch die Verwendung von chiralen Katalysatoren wurden erstmals durch Allway und Grigg 1991 beschrieben.[16] Diese Methode wurde durch Jørgensen und Zhang weiterentwickelt. Diese Reaktionen verwenden Metallkomplexe von Zn, Ag, Cu, Ni und Ca. Durch chirale Phosphin-Katalyse können enantiomerenreine Spiroindolinone synthetisiert werden. Die Methode, beschrieben von Gong et al. führt zu einer unerwarteten Regiochemie, die nicht durch elektronische Effekte bestimmt wird, sondern durch π-Stacking mit dem Katalysator.[17] Weitere ReaktionenElektrocyclisierungenKonjugiuerte Azomethin-Ylide können [1,5]- und [1,7]-Elektrocyclisierungen eingehen.[18] Ein Beispiel einer [1,7]-Elektrocyclisierung eines Diphenylethenyl-substituierten Azomehtin-Ylids ist abgebildet. Dem konrotatorischen Ringschluss folgt ein suprafacialer [1,5]-Hydridshift, wodurch das Produkt rearomatisiert. Die Sterik und Geometrie des Phenylring spielen eine entscheidende Rolle bei dieser Reaktion.[19]  Die Produkte dieser Reaktion werden in Diels-Alder-Reaktionen genutzt, um Fullerene zu modifizieren.[20] In der SyntheseTotalsynthese von martinellic acid In dieser Synthese von martinellic acid (etwa martinellsche Säure) wird eine Cycloaddition mit einem unaktivierten Alken verwendet. In diesem Schlüsselschritt werden zwei Ringe aufgebaut, darunter ein Pyrrolidin, sowie zwei Stereozentren.[21] Totalsynthese von Spirotryprostatin A In der Synthese von Spirotryprostatin A wird ein Azomethin-Ylid durch die Kondensation eines Amins mit einem Aldehyd erhalten. Das Ylid reagiert mit einem elektronenarmen Alken, das an eine Indolinon gebunden ist. Es entsteht ein spiroanneliertes Pyrrolidin und vier zusammenhängende Stereozentren.[22] Synthese von Benzodiazepinonen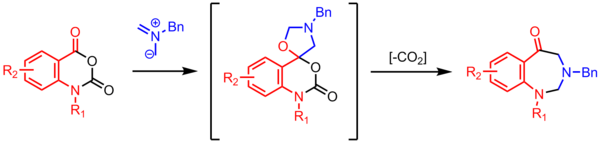 Cyclisierung eines Azomethin-Ylids mit einem Carbonyl resultiert in einem spiroannelierten Oxazolidin. Unter Abspaltung von CO2 bildet sich ein 7-gliedriger Ring.[23] Einzelnachweise
|
Portal di Ensiklopedia Dunia