|
Epòxid
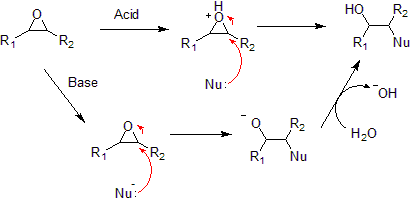
Un epòxid és un éter cíclic format per un anell de tres àtoms. Aquest anell té, aproximadament, la forma d'un triàngle equilàter, la qual cosa el fa altament tibant i tens. Aquesta característica confereix al grup epòxid la propietat de ser més reactiu que altres éters. Els epòxids simples s'anomenen a partir del compost "parental", que és l'òxid d'etilè o oxirà, tal com passa amb el clorometiloxirà. Com a grup funcional, els epòxids s'anomenen emprant el prefix epoxi en compostos tals com l'1,2-epoxycicloheptà, també conegut com a epòxid ciclohepté o, simplement, òxid ciclohepté.  S'anomena poliepoxi o epoxi a un polímer que contingui unitats epoxi que no han reaccionat entre si. Les resines d'epoxi són utilitzades com adhesius i material estructural. La polimerització d'un epòxid dona lloca a un polieter. L'òxid d'etilè, per exemple, polimeritza i forma el polietilenglicol, també conegut com a òxid de polietilè. SíntesiEls epòxids industrials majoritaris són l'òxid d'etilè i l'òxid de propilè, els quals són produïts en l'ordre de 15 i 3 milions de tones,[1] respectivament. L'epoxidació de l'etilè implica la reacció catalítica de l'oxigen, segons la següent estequiometria: 7 H₂C=CH₂ + 6 O₂ → 6 C₂H₄O + 2 CO₂ + 2 H₂O La reacció directa de l'oxigen en alquens és útil només en aquest epòxid. Altres alquens, fins i tot el propilè, no reaccionen de forma útil energèticament. Peroxidació de l'olefinaLa majoria dels epòxids són generats mitjançant la unió d'alquens amb reactius que continguin peròxids, els quals cedeixen un sol oxigen. Els reactius amb peròxid més típics són el peròxid d'hidrogen (aigua oxigenada), els àcids peroxicarboxílics (creats in situ o formats prèviament). Per aplicacions específiques, s'utilitzen altres reactius, com el dimetildioxirà. L'aplicació a major escala d'aquest mètode és la producció d'òxid de propilè a partir de propilè mitjançant l'ús d'hidroperòxid de t-butil o bé hidroperòxid d'etilbenzè.[2] En l'àmbit del laboratori, s'empra típicament la reacció de Prilezhaev.[3][4] Aquest mètode implica l'oxidació de l'alquè amb un peroxiàcid tal com m-CPBA. Un exemple és l'epoxidació de l'estirè amb àcid perbenzoic per obtenir òxid d'estirè:[5] La reacció avança a través del que es coneix comunament com el mecanisme Papallona.[6] El peròxid és considerat com l'electròfil, i l'alquè, com a nucleòfil. La reacció es produeix de forma coordinada (els nombres que apareixen en l'esquema que segueix a l'enllaç següent són una manera de simplificar la interpretació del procés): Els hidroperòxids també s'empren en epoxidacions catalítiques enantioselectives, tals com l'epoxidació de Sharpless i l'epoxidació de Jacobsen. En aquests casos, l'oxigen és captat d'un òxid metàl·lic o d'un peròxid. Juntament amb l'epoxidació de Shi, aquestes reaccions són útils per a la síntesi d'epòxids quirals. Substitució de l'SN2 intramolecularAquest mètode és una variant de la síntesi d'èters de Williamson. En aquest cas, un ió alcalòxid desplaça un àtom de clor dins la mateixa molècula. Els compostos del precursor s'anomenen halohidrins. Per exemple, amb 2-cloropropanol, té lloc la reacció següent:[7]  Aproximadament la meitat de l'abastiment mundial de l'òxid de propilè s'aconsegueix a través d'aquesta ruta.[2] La reacció per formar un epòxid intramolecular és un dels passos clau en la reacció de Darzens. En la reacció de Johnson-Corey-Chaykovsky els epòxids són generats a partir de grups carbonils i ilurs sulfoni. A aquesta recció, el sulfoni actua com el grup deixant en comptes del clorur. Epoxidació NucleofílicaLes olefines amb manca d'electrons, tals com les enones i els derivats de l'àcid acrílic poden ser epoxidades emprant compostos amb oxigen nucleofílic tals com els peròxids. La reacció segueix un mecanisme que es dona en dues etapes. Primer l'oxigen possibilita l'addició conjugada d'un nucleofílic amb l'objectiu de donar carbanions estables. Després, aquest carbanió col·lideix amb el mateix àtom d'oxigen, desplaçant el grup deixant d'aquest, per tancanr l'anell epòxid. Epoxidació asimètricaEls àtoms de carboni d'un grup epòxid presenten unes hibridacions semblants a les sp3, i per aquesta raó poden ocupar posicions estereogèniques. Segons els mecanismes de la recció i la geometria de l'alquè del material inicial, es poden formar diastereòmers epòxid de tipus cis i/o trans. A més a més, si hi ha altres estereocentres presents al material inicial, llavors aquests poden influir l'estequiometria de l'epoxidació relacionada amb aquests. Aquesta diastereoselectivitat és una manera de controlar el substrat de la reacció. Finalment, agents epoxidatius amb estructures estereogèniques poden influir l'estequiometria del producte epòxid (vegeu, per exemple, l'epoxidació Sharpless i l'epoxidació Jacobsen). Aquesta enantioselectivitat és una manera de control dels reactius de la reacció. ReaccionsLes reaccions típiques amb epòxids són les que segueixen a continuació:
PerepòxidsEls perepòxids són epòxids amb un àtom addicional d'oxigen units formant un complex epòxid-oxigen. Són isoelectrònics i isoestructurals amb sulfòxids cíclis derivats d'episulfurs. Es creu que els perepòxids són uns intermediaris en l'oxidació fotosensibilitzable dels alquens, tal com passa quan els olis secants (un component d'algunes pintures i vernissos) s'exposen a l'aire i a la llum. Aquests intermediaris apareixen de l'addició d'oxigen diatòmic al doble enllaç. Els perepòxids ràpidament es reorganitzen per formar peròxids orgànics de tipus alil (un grup alquè amb la fórmula CH2=CH-CH2).[3] Referències
|
||||||
Portal di Ensiklopedia Dunia