|
IsomerDalam ilmu kimia, isomer ialah molekul-molekul dengan rumus kimia yang sama (dan sering dengan jenis ikatan yang sama), tetapi memiliki susunan atom yang berbeda (dapat diibaratkan sebagai sebuah anagram). Kebanyakan isomer memiliki sifat kimia yang mirip satu sama lain. Juga terdapat istilah isomer nuklir, yaitu inti-inti atom yang memiliki tingkat eksitasi yang berbeda. Contoh sederhana dari suatu isomer adalah C3H8O. Terdapat 3 isomer dengan rumus kimia tersebut, yaitu 2 molekul alkohol dan sebuah molekul eter. Dua molekul alkohol yaitu 1-propanol (n-propil alkohol, I), dan 2-propanol (isopropil alkohol, II). Pada molekul I, atom oksigen terikat pada karbon ujung, sedangkan pada molekul II atom oksigen terikat pada karbon kedua (tengah). Kedua alkohol tersebut memiliki sifat kimia yang mirip. Sedangkan isomer ketiga, metil etil eter, memiliki perbedaan sifat yang signifikan terhadap dua molekul sebelumnya. Senyawa ini bukan sebuah alkohol, tetapi sebuah eter, di mana atom oksigen terikat pada dua atom karbon, bukan satu karbon dan satu hidrogen seperti halnya alkohol. Eter tidak memiliki gugus hidroksil. 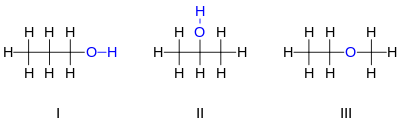 Terdapat dua jenis isomer, yaitu isomer struktural dan stereoisomer. Isomer struktural adalah isomer yang berbeda dari susunan/urutan atom-atom terikat satu sama lain. Contoh yang disebutkan di atas termasuk kedalam isomer struktural. Walaupun komposisi jumlah atom sama persis, belum tentu molekul-molekul isomer struktural mempunyai sifat yang sama. Sebagai contoh, sifat kimia siklobutana berbeda dengan butena. Padahal keduanya mempunyai rumus kimia yang sama, yaitu C4H8.[1] Beberapa jenis isomer struktural yaitu: isomer ionisasi, isomer koordinasi, dan isomer tautan.
Dua senyawa koordinasi yang rumusnya mempunyai ion pusat yang sama (Cr3+) dan lima dari enam ligannya (molekul NH3) adalah sama. Senyawa ini berbeda karena isomer pertama mempunyai ion SO42-sebagai ligan keenam, dengan ion netral Cl- menetralkan muatan ion kompleks, sedangkan isomer kedua memiliki Cl- sebagai ligan keenam dengan SO42- menetralkan muatan ion kompleks.[2]
Isomer koordinasi dapat muncul jika senyawa koordinasi tersusun atas kation kompleks dan anion kompleks. Ligan dapat dikontribusikan secara berbeda di antara kedua ion, seperti NH3(aq) dan CN-.[2]
Beberapa ligan dapat melekat pada ion logam atom pusat suatu ion kompleks dengan cara berbeda.[2]
Sedangkan stereoisomer memiliki struktur yang sama, tetapi beberapa atom atau gugus fungsional memiliki posisi geometri yang berbeda. Referensi
Pranala luar |
Portal di Ensiklopedia Dunia