LDLR与LDL结合的示意图,灰色圆形为钙离子,球棍模型为硫酸根离子,带状结构为LDLR 家族性高胆固醇血症 (英語:familial hypercholesterolemia ),缩写为FH ,是一种遗传性疾病 ,表现为血液中高胆固醇 水平(特别是极高的低密度脂蛋白(LDL) 水平)和早期心血管疾病 。 由于FH的基本生物化学 性质,不同人的情况略有不同,高胆固醇血症患者相对于不患有此症的患者对胆固醇控制手段的反应较不理想(如调整饮食和服用他汀类 药物)。然而,治疗(包括提高他汀类药物的剂量)通常是有效的。
许多人携带突变 的LDLR 基因 ,该基因编码LDL受体 蛋白质 ,该蛋白质正常情况下会将LDL从体内循环中清除出去,或LDL中与受体 结合的载脂蛋白B (ApoB);其他基因突变的概率很小。携带有杂合子 LDLR 基因的人可能会在30-40岁时患上早期心血管疾病。携带纯合子 的人则会在童年时期便患上严重的心血管疾病。杂合子FH是一种常见的遗传性疾病,通过常染色体 显性遗传 ,在大部分国家发病率为1:500,纯合子FH则罕见许多,几率为1:1,000,000(一百万分之一)。[ 1]
杂合子FH通常使用他汀类药物 、胆汁螯合剂 或其他可以降低胆固醇水平的降血脂药 来治疗。纯合子FH通常对药物治疗 没有反应,并且通常需要使用其他疗法,包括LDL血浆置换法 (用类似于透析 的方法除去血液中的LDL),有时候也会进行肝移植 。[ 1]
出于阅读的方便,一些专业名词以英文缩写的形式在本文中出现,以下列出释义:
高胆固醇水平通常不会表现出任何症状。身体的许多部位都可能会出现富含胆固醇的脂肪堆积形成的黄色斑块,如眼睑 (也称作黄斑瘤眉 ),虹膜的外缘,手部、手肘、膝盖和脚的肌腱,尤其是跟腱 (也称作肌腱黄色瘤 )。[ 1] [ 2]
胆固醇在动脉 壁的加速堆积会导致动脉粥样硬化 ,这也是导致心血管疾病 的根本原因。FH导致的最常见的问题是在比普通人的预计发病年龄年轻许多时便有冠状动脉疾病 的发展(为心脏 供血的冠状动脉 的粥样硬化)。这会导致心绞痛 或心脏病发作 。小部分情况下,大脑 的动脉会受到影响,这会导致短暂性脑缺血发作 (TIA)或中风 。外周动脉闭塞 (腿部动脉阻塞)主要发生于吸烟 人群中,这会导致行走时小腿肌肉 疼痛并发间歇性跛行 和脚部血液供应的问题(如导致坏疽 )。[ 3]
动脉粥样硬化的风险随着年龄的增长而增加,且吸烟、糖尿病 、高血压 和心血管疾病家族史 也会使风险提高。[ 1] [ 4]
FH中最常见的基因缺陷是LDLR 的突变(发病率为500人中1人,取决于人口基数)、ApoB的突变(发病率为1000人中1人)、PCSK9 LDLRAP1 sitosterolemia ,特征也为脂肪在组织中堆积,其原因是ABCG5 ABCG8 [ 1]
LDLR途径 LDL受体蛋白的示意图 LDL受体 基因 位于19号染色体 的短臂上(19p13.1-13.3)。[ 5] 外显子 ,跨越45个碱基对长度 单位,并且其蛋白基因产物包含839个氨基酸 。单异常副本(杂合子)FH中40%的患者会在50岁时患上心血管疾病。双异常副本(纯合子)FH患者在童年时便有加速动脉粥样硬化,并且会导致许多并发症。血浆中的LDL水平与LDL受体(LDLR)的活性成负相关。纯合子的LDLR的活性小于2%,而杂合子的LDLR活性在2-25%之间(取决于突变的性质)并伴随LDL代谢缺陷。目前已知有超过1000种不同类型的突变。[ 1]
根据LDLR 突变的性质,FH的类型主要分为以下五种:[ 6]
1类: LDLR没有完全合成.
2类: LDLR没有正常地从内质网 转运至高尔基体 并在细胞表面表达。
3类: LDLR没有正常地在细胞表面与LDL结合,因为载脂蛋白B100(R3500Q)或LDL-R内部有缺陷。
4类: LDLR与LDL结合时没有正常地聚集在网格蛋白 包被进行受体介导的内吞作用 (途径中的步骤2)。
5类: LDLR没有被正常地回收至细胞表面(途径中的步骤5)。
ApoB100形式的载脂蛋白B是主要的载脂蛋白 ,或是脂蛋白 颗粒的蛋白质部分。其对应的基因位于2号染色体(2p24-p23)上,长度在21.08至21.12兆碱基对长度单位之间。FH通常与R3500Q的突变有关,其导致3500号位置上的精氨酸 被替换为谷氨酰胺 。突变的部位位于与LDL受体结合的蛋白质的一部分,这导致了LDL与受体的结合率降低。与LDLR 类似,异常副本的数量决定了高胆固醇血症的严重性。[ 1] [ 7]
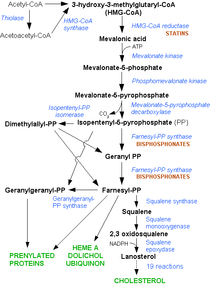
胆固醇通过HMG-CoA还原酶 途径合成 LDL胆固醇通常在体内循环2.5天,然后LDL胆固醇的载脂蛋白B 部分会与肝细胞 中的LDL受体 结合,并开始吸收和消化 。 [ 5] 肝脏 对胆固醇的合成受HMG-CoA还原酶途径 的控制。[ 8] [ 5] [ 3] ApoB 突变时,LDL颗粒与受体结合的数量会减少,并导致LDL胆固醇水平的升高。目前尚不清楚PCSK9 和ARH 的突变如何导致LDL受体的功能障碍。[ 1]
FH通常使用他汀类药物 治疗。[ 5] 肝脏 内抑制HMG-CoA还原酶 来发挥作用,结果是,肝脏会产生更多的LDL受体来清除血液中的LDL。他汀类药物可以有效降低胆固醇和LDL水平,即使有时候需要配合其他药物进行治疗,如胆汁螯合剂(消胆胺 或考来替泊 )、烟酸 制剂或贝特类药物 。[ 1] 弗雷明汉心脏研究 的结论),因为他们可能低估了心血管疾病发生的风险;不同于其他人,FH患者从出生开始胆固醇一直保持着较高的水平,这也许会增加相关风险。[ 9] 安妥明 (一种较老的贝特类药物,经常会导致胆结石 )、普罗布考 (特别是针对较大的黄色瘤)和甲状腺素 曾用来降低LDL胆固醇水平。
存在更大争议的药物是依泽替米贝,其作用为抑制胆对胆固醇的吸收。虽然它减少了LDL胆固醇,但是并没有提高一种叫做内膜中层厚度的动脉粥样硬化的标志。无论这意味着什么,依泽替米贝对FH的整体效果目前还不清楚。[ 10]
目前尚没有干预性研究 直接指出FH患者在胆固醇降低后死亡率也会降低。至少,有多项针对多基因遗传性高胆固醇血症 患者(遗传不是主要原因)的试验结果表明,对FH患者进行胆固醇控制是有益的。还有,1999年对大量英国人的观察性研究 发现,在他汀类药物发明后,FH患者的死亡率反而提高了。[ 11]
一项队列研究 指出,FH患者使用他汀类药物治疗后可以降低48%因冠状动脉心脏疾病 而死亡的几率,结果是FH患者死于冠状动脉心脏疾病的几率不会高于普通人。然而,如果已患上冠状动脉心脏疾病,那么导致死亡的几率会下降25%。这个结果着重强调及早确诊FH并使用他汀类药物进行治疗的重要性。[ 12]
纯合子FH的治疗更加困难。
全球FH的流行人数约为1000万人。[ 5] [ 1] [ 1] [ 3]
LDLR 突变在特定人群中很常见,这大概是是因为一种称为「奠基者效应 」的遗传现象导致的,这种现象发现于有一人或是数人为突变载体的一小部分人中。南非荷兰人、法国加拿大人、黎巴嫩人、基督教徒和芬兰人的FH致病基因的突变率较高,使得FH在这些人群中格外流行。APOB 的突变则更常见于中欧。[ 1]
^ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 Rader DJ, Cohen J, Hobbs HH. Monogenic hypercholesterolemia: new insights in pathogenesis and treatment . J. Clin. Invest. 2003, 111 (12): 1795–803. PMC 161432 PMID 12813012 doi:10.1172/JCI18925 ^ Tsouli SG, Kiortsis DN, Argyropoulou MI, Mikhailidis DP, Elisaf MS. Pathogenesis, detection and treatment of Achilles tendon xanthomas. Eur. J. Clin. Invest. 2005, 35 (4): 236–44. PMID 15816992 doi:10.1111/j.1365-2362.2005.01484.x ^ 3.0 3.1 3.2 Durrington P. Dyslipidaemia. Lancet. 2003, 362 (9385): 717–31. PMID 12957096 doi:10.1016/S0140-6736(03)14234-1 ^ Jansen AC, van Aalst-Cohen ES, Tanck MW, et al. The contribution of classical risk factors to cardiovascular disease in familial hypercholesterolaemia: data in 2400 patients . J. Intern. Med. 2004, 256 (6): 482–90. PMID 15554949 doi:10.1111/j.1365-2796.2004.01405.x ^ 5.0 5.1 5.2 5.3 5.4 Repas TB, Tanner JR. Preventing early cardiovascular death in patients with familial hypercholesterolemia . J Am Osteopath Assoc. February 2014, 114 (2): 99–108 [2015-09-19 ] . PMID 24481802 doi:10.7556/jaoa.2014.023 原始内容 存档于2014-03-11). ^ Hobbs HH, Brown MS, Goldstein JL. Molecular genetics of the LDLR gene in familial hypercholesterolemia. Hum. Mutat. 1992, 1 (6): 445–66. PMID 1301956 doi:10.1002/humu.1380010602 ^ Vega GL, Grundy SM. In vivo evidence for reduced binding of low density lipoproteins to receptors as a cause of primary moderate hypercholesterolemia . J. Clin. Invest. 1986, 78 (5): 1410–4. PMC 423848 PMID 3771801 doi:10.1172/JCI112729 ^ Brown MS, Goldstein JL. Familial hypercholesterolemia: defective binding of lipoproteins to cultured fibroblasts associated with impaired regulation of 3-hydroxy-3-methylglutaryl coenzyme A reductase activity . Proc. Natl. Acad. Sci. U.S.A. 1974, 71 (3): 788–92. PMC 388099 PMID 4362634 doi:10.1073/pnas.71.3.788 ^ National Institute for Health and Clinical Excellence Clinical guideline 71: Familial hypercholesterolaemia ^ Kastelein JJ, Akdim F, Stroes ES, et al. Simvastatin with or without ezetimibe in familial hypercholesterolemia. N. Engl. J. Med. April 2008, 358 (14): 1431–43. PMID 18376000 doi:10.1056/NEJMoa0800742 ^ Scientific Steering Committee on behalf of the Simon Broome Register Group. Mortality in treated heterozygous familial hypercholesterolaemia: implications for clinical management. Atherosclerosis. 1999, 142 (1): 105–12. PMID 9920511 doi:10.1016/S0021-9150(98)00200-7 ^ Neil A, Cooper J, Betteridge J, et al. Reductions in all-cause, cancer, and coronary mortality in statin-treated patients with heterozygous familial hypercholesterolaemia: a prospective registry study . Eur. Heart J. November 2008, 29 (21): 2625–33 [2015-09-18 ] . PMC 2577142 PMID 18840879 doi:10.1093/eurheartj/ehn422 存档 于2016-12-20).