|
Platin(IV) chloride
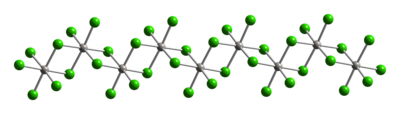
Platin(IV) chloride hay bạch kim(IV) chloride là một hợp chất vô cơ của platin và chlor với công thức hóa học PtCl4. Chất rắn màu nâu này chứa platin ở trạng thái oxy hóa +4. Cấu trúcLà một hợp chất điển hình của Pt(IV), các trung tâm kim loại có dạng hình học phối trí bát diện, {PtCl6}. Cấu trúc này đạt được bằng cách tạo thành một polyme; trong đó, một nửa chloride làm cầu nối giữa các trung tâm platin. Do cấu trúc polyme của nó, PtCl4 chỉ tan khi phá vỡ các phối tử cầu nối chloride. Do đó, thêm HCl sẽ tạo H2PtCl6. Acid và base Lewis của Pt(IV) của các loại cis-PtCl4L2 được biết đến, nhưng hầu hết được điều chế bởi quá trình oxy hóa của dẫn xuất Pt(II).
Sự hình thành và phản ứngPtCl4 chủ yếu gặp trong việc xử lý axit hexacloroplatinic(IV), thu được bằng cách hòa tan kim loại Pt trong nước vương thủy. Gia nhiệt H2PtCl6 thì thu được PtCl4:
Nếu axit dư được loại bỏ, PtCl4 kết tinh từ dung dịch nước trong tinh thể lớn màu đỏ của pentahydrat PtCl4·5H2O,[2] có thể bị khử nước bằng cách đun nóng đến khoảng 300 ℃ trong dòng clo khô. Pentahydrat ổn định và được sử dụng làm dạng thương mại của PtCl4. Xử lý PtCl4 bằng nước tạo ra ion hexahydroxoplatinat(IV), [Pt(OH)6]2−. Với thuốc thử metyl Grignard sau khi thủy phân một phần, PtCl4 chuyển thành phức hình khối [Pt(CH3)3(OH)]4.[3] Khi đun nóng PtCl4, hợp chất bị mất clo để tạo PtCl2:
Các halogen nặng hơn, PtBr4 và PtI4, cũng được biết đến. Hợp chất khácPtCl4 còn tạo một số hợp chất với NH3, như PtCl4·2NH3 là tinh thể vàng cam tan trong nước (cis-), tinh thể bát diện màu vàng chanh (trans-), PtCl4·3NH3 là tinh thể dạng lá sáng bóng màu vàng tan trong nước, PtCl4·4NH3 là tinh thể bát diện cỡ micromet màu vàng nhạt[4], PtCl4·5NH3·H2O là tinh thể không màu, D = 2,58 g/cm³[5] hay PtCl4·6NH3 là tinh thể hình kim không màu.[4] Tham khảo
Đọc thêm
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||