|
Хімічна кінетика
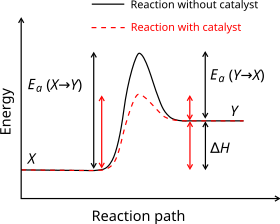
Хімічна кінетика — розділ хімії, що вивчає протікання хімічних процесів. У цьому розділі вивчається також вплив різних умов на швидкість хімічних реакцій, механізми реакції, знаходження і характеристика перехідних станів. Швидкість хімічної реакціїДив. також окрему статтю Швидкість хімічної реакції Інтенсивність проходження хімічних реакцій визначається швидкістю, тобто зміною концентрації реагуючої речовини або продукту реакції за одиницю часу: де С – молярна концентрація реагуючої речовини, а t – час. Мінус перед правим членом обумовлений зниженням концентрації реагуючої речовини в ході реакції. У виразі швидкості реакції за зміною концентрації продукту реакції мінус не ставиться. Отже, швидкість рекції завжди позитивна. Швидкість хімічної реакції також визначається законом діючих мас, що був висунутий Бекетовим, а потім формульований Гульдберґом і Вааґе у 1867 році. За цим законом швидкість хімічної реакції при постійній температурі прямо пропорційна добуткові концентрацій реагуючих речовин у степеням, які дорівнюють стехіометричним коефіцієнтам у відповідному рівнянні реакції. Молекулярність і порядок реакційМолекулярність реакцій визначають кількістю молекул, які взаємодіють між собою і тим обумовлюють хімічне перетворення. Мономолекулярні реакції — реакції розкладу, наприклад, розклад молекули йоду на атоми. Коли ж проходження реакції визначається взаємодією двох молекул реагуючих речовин, то така реакція називається бімолекулярною. Здебільшого бувають мономолекулярні, бімолекулярні та тримолекулярні реакції. Оскільки одночасне зіткнення великої кількості молекул малоймовірне, то реакції, в яких бере участь більше трьох молекул реагуючих речовин, відбуваються через кілька бімолекулярних або тримолекулярних стадій реакцій. Тому практично нема реакцій з вищою молекулярністю, ніж три. Порядок реакції визначають сумою показників степені концентрації у виразі закону діючих мас. Отже, порядок і молекулярність реакції не завжди збігаються. Див. такожДжерела
Література
Посилання
|
||||||||