|
Хлоралгідрат
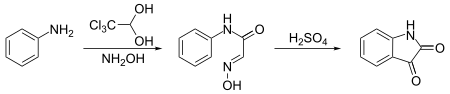
Хлоралгідрат — це гемінальний двоатомний спирт із формулою Cl3CCH(OH)2. Вперше він був використаний як заспокійливий і снодійний засіб у Німеччині в 1870-х роках. Згодом його замінили безпечніші та ефективніші альтернативи, але він залишався у використанні в Сполучених Штатах принаймні до 1970-х років.[2] Іноді він використовується як лабораторний хімічний реагент і прекурсор. Його отримують з хлоралю (трихлорацетальдегіду) додаванням одного еквівалента води. Вперше було отримано 1832 року Юстусом фон Лібіхом при хлоруванні етанолу. ОтриманняХлоралгідрат можна отримати безпосередньо з хлору та етанолу в кислому розчині як в промислових, так і в лабораторних масштабах. Реакція відбувається шляхом окислення та подальшого хлорування етанолу елементарним хлором, потім хлораль, що утворився реагує з водою з утворенням хлоралгідрату: Хлоральгідрат - одна з небагатьох органічних сполук, існування якої суперечить правилу Ельтекова - нестабільності 1,1-діолів. Зазвичай при утворенні двох гідроксильних груп при одному атомі вуглецю в процесі будь-якої реакції призводить до відщеплення молекули води. Але вплив трьох атомів хлору біля сусіднього атома вуглецю стабілізує молекулу хлоральгідрату. ВикористанняВ органічному синтезіХлоралгідрат є вихідним реагентом для синтезу інших органічних сполук. Він застосовується для виробництва хлоралю, який отримують дистиляцією суміші хлоралгідрату та сульфатної кислоти, яка служить десикантем. Також, він використовується для синтезу ізатину. У цьому синтезі хлоралгідрат реагує з аніліном і гідроксиламіном з утворенням продукту конденсації, який циклізується в сульфатній кислоті з утворенням цільової сполуки:[3] Крім того, хлоралгідрат використовується як реагент для зняття захисту з ацеталів, дитіоацеталів та тетрагідропіранілових ефірів в органічних розчинниках.[4] Сполука може кристалізуватися у різноманітних поліморфах.[5] Ботаніка і мікологіяРеактив МельцераХлоралгідрат використовується для виготовлення реактиву Мельцера, водний розчин, яого використовується для ідентифікації певних видів грибів. Іншими інгредієнтами є йодид калію та йод. Реакція тканин або спор на цей реактив є життєво важливою для правильної ідентифікації деяких грибів. Примітки
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||