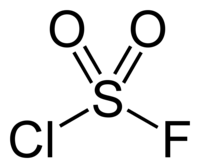
Сульфурил хлорид фторид
Структурна формула сульфурил хлорид фториду
{{{ImageAltL2}}}
Назва за IUPAC
Сульфурил хлорид фторид
Інші назви
Фторхлор сульфурил, TL - 212
Ідентифікатори
Номер CAS
13637-84-8 PubChem
26159 Номер EINECS
237-126-2 ChEBI
39445 RTECS
WT4900000 SMILES
ClS(F)(=O)=O InChI
1/ClFO2S/c1-5(2,3)4 Номер Гмеліна
1993
Властивості
Молекулярна формула
ClFO2 S
Молярна маса
118.52 г/моль
Зовнішній вигляд
безбарвний газ
Густина
1.623 г/см3 при 0 °C
Тпл
−124.7
Розчинність (вода )
гідроліз
Розчинність (інші розчинники )
SO2 та етери
Структура
Координаційна
тетраедрична
Небезпеки
ГГС піктограми
ГГС формулювання небезпек
301 , 311 , 314 , 331
ГГС запобіжних заходів
260 , 261 , 264 , 270 , 271 , 280 , 301+310 , 301+330+331 , 302+352 , 303+361+353 , 304+340 , 305+351+338 , 310 , 311 , 312 , 321 , 322 , 330 , 361 , 363 , 403+233 , 405 , 501
Головні небезпеки
помірно токсичний, корозійний
Пов'язані речовини
Пов'язані речовини
SO2 Cl2 ,SO2 F2 ClSO2 (NCO)
Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа)
Інструкція з використання шаблону
Примітки картки
Chemical compound
Сульфурил хлорид фторид — хімічна сполука з формулою SO2 ClF. Це безбарвний газ, який легко конденсується. Має тетраедричну молекулу.
Зріджений хлорид фторид сульфурил використовується як розчинник сильноокислювальних сполук.[ 1]
Синтез в лабораторних масштабах починається з отримання фторсульфіту калію :[ 2]
SO2 + KF → KSO2 F Цю сіль потім хлорують, щоб отримати хлорид фторид сульфурилу[ 3]
KSO2 F + Cl2 → SO2 ClF + KCl Подальший нагрів (180 °C) фторсульфіту калію з хлорид-фторид сульфурилом дає сульфурил фторид.
KSO2 F + SO2 ClF → SO2 F2 + KCl + SO2 Як варіант, хлорид-фторид сульфурилу можна отримати без використання газів як вихідних матеріалів шляхом обробки сульфурил хлориду (інші мови) фторидом амонію (інші мови) або фторидом калію в трифтороцтовій кислоті .[ 4]
SO2 Cl2 + NH4 F → SO2 ClF + NH4 Cl
↑ Koppe, Karsten; Bilir, Vural; Frohn, Hermann-J.; Mercier, Hélène P. A.; Schrobilgen, Gary J. (2007). Syntheses, Solution Multi-NMR Characterization, and Reactivities of [C6 F5 Xe]+Salts of Weakly Coordinating Borate Anions, [BY4]-(Y = CF3 , C6 F5 , CN, or OTeF5 ). Inorganic Chemistry . 46 (22): 9425—9437. doi :10.1021/ic7010138 . PMID 17902647 . ↑ Seel, F.; Czerepinski, Ralph G.; Cady, George H. (1967). Potassium Fluorosulfite: (Potassium Fluorosulfinate). Inorganic Syntheses . Т. 9. с. 113—115. doi :10.1002/9780470132401.ch29 . ISBN 978-0-470-13240-1 ↑ Seel, F.; Duncan, Leonard C.; Czerepinski, Ralph G.; Cady, George H. (1967). Sulfuryl Chloride Fluoride and Sulfuryl Fluoride. Inorganic Syntheses . Т. 9. с. 111—113. doi :10.1002/9780470132401.ch28 . ISBN 9780470132401 ↑ Prakash Reddy, V.; Bellew, Donald R.; Prakash, G. K. Surya (1992). A Convenient Preparation of Sulfuryl Chloride Fluoride. Journal of Fluorine Chemistry . 56 (2): 195—197. doi :10.1016/S0022-1139(00)81102-1 .