|
Пентафторид стибію
Пентафторид стибію — неорганічна сполука з хімічною формулою SbF5. Ця безбарвна в’язка рідина є сильною кислотою Льюїса та є компонентом фторантимонової кислоти — суперкислоти, що утворюється при змішуванні рідкого фтороводню з рідким пентафторидом стибію у співвідношенні 1:1. Він відрізняється здатністю реагувати практично з усіма відомими сполуками.[1] ПідготовкаПентафторид стибію отримують реакцією пентахлориду стибію з безводним фтороводнем:[2]
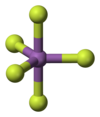
Його також можна приготувати з трифториду стибію та фтору.[3] Будова та хімічні реакціїУ газовій фазі пентафторид стибію приймає тригональну біпірамідальну структуру D3h точкової групи симетрії (див. малюнок). Речовина приймає більш складну структуру в рідкому і твердому станах. Рідина містить полімери, у яких кожен стибій є октаедричним, структуру описують формулою [SbF4(μ-F)2]n ((μ-F) вказує на той факт, що фторидні центри сполучають два центри стибію). Кристалічний матеріал є тетрамером, що означає, що він має формулу [SbF4(μ-F)]4. Зв'язки стибію та фтору становлять 2,02 Å у восьмичленному кільці Sb4F4; інші фторидні ліганди, що випромінюються від чотирьох центрів стибію, коротші на 1,82 Å.[4] Пов'язані речовини пентафторид фосфору та пентафторид арсену є мономерними у твердому та рідкому станах, ймовірно, через менші розміри центрального атома, що обмежує їх координаційне число. Пентафторид бісмута є полімером.[5] Пентафторид стибію окислює кисень у присутності фтору:[6]
Пентафторид стибію сам по собі також є дуже сильним окиснювачем. Фосфор при контакті з ним горить. SbF5 також використовувався в першій відкритій хімічній реакції, яка утворює газоподібний фтор із сполук фтору:
Рушійною силою цієї реакції є висока спорідненість пентафториду стибію до F−, що є тією самою властивістю, що рекомендує використання SbF5 для генерування суперкислот. ГексафторантимонатSbF5 є сильною кислотою Льюїса, винятково по відношенню до джерел F−, утворюючи дуже стабільний аніон [SbF6]−, який називається гексафторантимонат. Це сполучена основа суперкислоти фторантимонова кислота. [SbF6]− є слабокоординаційним аніоном, подібним до PF6−. Незважаючи на те, що [SbF6]– є слабкоосновною, вона реагує з додатковим SbF 5, утворюючи центросиметричний аддукт:
Аніон [Sb2F11]- є одним із іонів, які містяться в суміші фторантимонової кислоти. БезпекаПентафторид стибію бурхливо реагує з водою. Він реагує з багатьма сполуками, часто вивільняючи небезпечний фтороводень. Він дуже токсичний і їдкий для шкіри та очей. Сильний окиснювач.[7][8] Примітки
Посилання |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||