|
| Октан
|

Скелетна формула октану
|
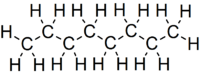
Скелетна формула октану з усіма атомами вуглецю та атомами водню
|

Кулестержнева модель молекули бутилацетату
|

Просторова модель октану
|
| Систематична назва
|
октан[1]
|
| Ідентифікатори
|
| Номер CAS |
111-65-9 |
|---|
| Номер EINECS |
203-892-1 |
|---|
| KEGG |
C01387 |
|---|
| ChEBI |
17590 |
|---|
| RTECS |
RG8400000 |
|---|
| SMILES |
CCCCCCCC[2] |
|---|
| InChI |
InChI=1S/C8H18/c1-3-5-7-8-6-4-2/h3-8H2,1-2H3 |
|---|
| Номер Бельштейна |
1696875 |
|---|
| Номер Гмеліна |
82412 |
|---|
| Властивості
|
| Молекулярна формула
|
C8H18
|
| Молярна маса
|
114,23 г/моль
|
| Зовнішній вигляд
|
Безбарвна рідина
|
| Запах
|
Бензоподібний
|
| Густина
|
0,703 г/см3
|
| Тпл
|
від −57,1 до −56,6 °C; від −70,9 до −69,8 °F; від 216,0 до 216,6 К
|
| Ткип
|
від 125,1 до 126,1 °C; від 257,1 до 258,9 °F; від 398,2 до 399,2 К
|
| Розчинність (вода)
|
0,007 мг/дм3 (при 20 °C)
|
| В'язкість
|
0,509 мПа·с (25 °C)[3]
0,542 мПа·с (20 °C)
|
| Термохімія
|
Ст. ентальпія
утворення ΔfHo
298
|
від −252,1 до −248,5 кДж/моль
|
Ст. ентальпія
згоряння ΔcHo
298
|
від -5,53 до -5,33 МДж/моль
|
Ст. ентропія So
298
|
361,20 Дж/(моль·К)
|
Теплоємність, co
p
|
255,68 Дж/(моль·К)
|
| Пов'язані речовини
|
| Інші (група)
|
алкани
|
| Пов'язані речовини
|
Метан, Етан, Пропан, Бутан, Пентан, Гексан, Гептан
|
| Небезпеки
|
| ГДК (США)
|
500 ppm (2350 мг/м3)
|
| ГГС піктограми
|
   
|
| ГГС формулювання небезпек
|
225, 304, 315, 336, 410
|
| ГГС запобіжних заходів
|
210, 261, 273, 301+310, 331
|
| NFPA 704
|
|
| Вибухові границі
|
0.96 – 6.5%
|
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа)
|
| Інструкція з використання шаблону
|
| Примітки картки
|
Окта́н (від грец. octa — вісім) — насичений вуглеводень (алкан) складу C8H18. Молекулярна маса — 114,224. Має 18 ізомерів.
Октан — безбарвна рідина зі слабким запахом прямогонного бензину, необмежено змішується з вуглеводнями, погано розчинний у діетиловому ефірі, ацетоні і етанолі, практично не розчинний у воді. Октани легко запалюються, в суміші з повітрям вибухонебезпечні. Нетоксичні, не мають алергенних і канцерогенних властивостей.
Ізомерія
Октан має 18 структурних ізомерів:
- Октан (н-октан)
- 2-Метилгептан
- 3-Метилгептан (+ має оптичну ізомерію)
- 4-Метилгептан
- 3-Етилгексан
- 2,2-Диметилгексан
- 2,3-Диметилгексан (+ має оптичну ізомерію)
- 2,4-Диметилгексан (+ має оптичну ізомерію)
- 2,5-Диметилгексан
- 3,3-Диметилгексан
- 3,4-Диметилгексан (+ має оптичну ізомерію (два хиральних центри))
- 2-Метил-3-етилпентан
- 3-Метил-3-етилпентан
- 2,2,3-Триметилпентан (+ має оптичну ізомерію)
- 2,2,4-Триметилпентан (також відомий як ізооктан)
- 2,3,3-Триметилпентан
- 2,3,4-Триметилпентан
- 2,2,3,3-Тетраметилбутан
Отримання
Октан міститься в бензиновій фракції нафти та продуктах її деструктивної переробки, в алкілаті, утворюється при синтезі вуглеводнів за процесом Фішера-Тропша. У промисловості його виділяють із зазначених продуктів ректифікацією у поєднанні з селективною адсорбцією на цеолітах або комплексоутворенням з сечовиною. У лабораторних умовах отримують гідруванням октенів, за реакцією Вюрца з 1-хлорбутану.
Хімічні властивості
При піролізі октану утворюються в основному метан, етан, етилен; при крекінгу на алюмосилікатному каталізаторі зростає вихід вуглеводнів С3-С5; у присутності ароматизуючих каталізаторів (Pt/C, оксидів Cr, Mo, V на Al2O3) при 450—500 °C з високим виходом утворюється суміш о-ксилену і стирену.
Застосування
Застосовують октан у виробництві ксиленів, октанолу, октаналю, а також як розчинник. Як компонент бензину великого значення не має через низьку детонаційну стійкість (октанове число 19).
Джерела
- Петров Ал. А. Химия алканов. — М. : Наука. — 1974. — 243 с.
Примітки
|