|
Цитохром-bc1-комплекс
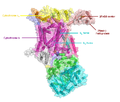
Цитохро́м-bс1-ко́мплекс (комплекс цитохромов bc1) или убихинол-цитохром с-оксидоредуктаза, или комплекс III — мультибелковый комплекс дыхательной цепи переноса электронов и важнейший биохимический генератор протонного градиента на мембране митохондрий. Этот мультибелковый трансмембранный комплекс кодируется митохондриальным (цитохром b) и ядерным геномами[2]. Комплекс III был выделен из митохондрий сердца быка, цыпленка, кролика и митохондрий дрожжей. Он присутствует в митохондриях всех животных, растений и всех аэробных эукариот, а также на внутренней мембранах большинства эубактерий. Известно, что комплекс образует в целом 13 белковых петель, пересекающих мембрану[2]. Структурная организация комплекса IIIВ состав комплекса из митохондрий сердца быка (мол. масса ~ 248 кДа) входит порядка 11 белковых субъединиц, 8 из которых представляют собой мелкие гидрофобные мембранные белки с неизвестной (возможно, структурной) функцией. Бактериальные цитохромные комплексы могут содержать всего от 6 до 8 или даже 3 субъединицы[3]. Три главные субъединицы несут простетические группы. Цитохром b, в составе которого есть два гема b-типа с разными редокс-потенциалами: гем bL низким (Е°’~ —0,075…0,00 В) и гем bH с высоким (Е°' ~ — +0,05 В) потенциалом. Цитохром с1 несёт простетическую группу, гем типа-с (Е°' -+0,23…+0,25 В). Железосерный белок Риске имеет в своём составе 2Fe-2S-центр (Е°' ~ +0,28 В). Известно, что in vivo комплекс функционирует как димер[2]. Комплекс погружён во внутреннюю митохондриальную мембрану таким образом, что функциональная группа белка Риске и цитохрома с выходят в межмембранное пространство, тогда как два гема цитохрома b находятся в толще мембраны, причём bp приближен к её внутренней стороне, а bn — к наружной. Такое асимметричное расположение редокс-центров в мембране обеспечивает существование двух пространственно разделённых цепей транспорта электронов внутри одного комплекса. Первая, низкопотенциальная цепь транспорта электронов формируется за счёт двух гемов цитохрома b6 — низкопотенциального bL и высокопотенциального bH. Вторая, высокопотенциальная цепь включает белок Риске и гем цитохрома c. При окислении убиохинолов в цитохромном комплексе реализуется два сопряжённых потока электронов — по низкопотенциальному и высокопотенциальному пути[4]. Данные рентгеноструктурного анализа, позволяющие определить положение активных групп относительно друг друга, а также эксперименты с ингибиторами дали возможность понять, что электронный транспорт возможен не только между двумя гемами одного комплекса, но и между двумя гемами bL, расположенными на разных комплексах, ассоциированных в димер[5]. СубъединицыУ позвоночных bc1-комплекс, или Комплекс III, состоит из 11 субъединиц: 3 каталитических субъединиц, 2 коровые субъединицы и 6 низкомолекулярных субъединиц[6][7]. Протеобактериальные комплексы могут состоять всего из трёх субъединиц[8]. У растений Комплекс III бифункционален. Недавние исследования на митохондриях пшеницы (Triticum aestivum), картофеля (Solanum tuberosum) и шпината (Spinacia oleracea) показали, что две коровые субъединицы комплекса, обращенные в матрикс, обладают MPP (англ. Mitochondrial Processing Peptidase) — пептидазной активностью и принимает участие в транспорте белков в митохондрии[9][10]. MPP-пептидаза — это гетеродимер, который состоит из субъединиц α-MPP и β-MPP, каждая весом 50 кДа. Она отрезает у поступающих в митохондрию белков N-концевую сигнальную или транзитную последовательность из 40-80 аминокислот. В растениях MPP-пептидаза входит в состав цитохром-bc1-комплекса, что считается архаичным признаком. У животных произошла дупликация генов коровых субъединиц, так что MPP-пептидаза у них присутствует как независимый водорастворимый белок матрикса. Коровые субъединицы цитохром-bc1-комплекса тем не менее не утратили пептидазой активности, однако в составе bc1-комплекса она блокируется 9-й субъединицей, которая образуется в результате процессинга белка Риске. Тем не менее опыты с бычьим цитохром-bc1-комплексом показали, что при воздействии детергентов и диссоциации 9-й субъединицы коровые субъединицы вновь приобретают пептидазную активность[11]. Таблица субъединиц Комплекса III
TTC19 — недавно открытая малая субъединица комплекса; мутации в ней приводят к недостаточности комплекса III 2-го типа. Реакция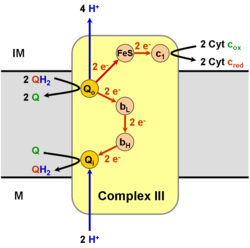 Цитохром-bс1-комплекс окисляет восстановленный убихинон (убихинол) и восстанавливает цитохром c (Е°'=+0,25 В) согласно уравнению: QH2 + 2 цит. с+3 + 2Н+in →Q + 2 цит. с+2 + 4H+out При этом имеет место: (1) перенос двух электронов с убихинола на цитохром c, (2) перенос двух протонов из матрикса (in) в межмембранное пространство (out), (3) перенос еще двух протонов из убихинола в межмембранное пространство. В результате, на внутренней мембране митохондрии или бактерии генерируется протонный градиент, а восстановленный цитохром c движется вдоль мембраны в водной фракции и переносит один электрон к следующему дыхательному комплексу — цитохромоксидазе[12][13]. Q-циклСобытия, которые при этом происходят, известны как Q-цикл, который был постулирован Питером Митчеллом в 1976 году. Принцип Q-цикла состоит в том, что перенос Н+ через мембрану происходит в результате окисления и восстановления хинонов на самом комплексе. При этом хиноны соответственно отдают и забирают 2Н+ из водной фазы избирательно с разных сторон мембраны. В структуре комплекса III есть два центра, или два «кармана», в которых могут связываться хиноны. Один из них, Qout-центр, расположен между железосерным кластером 2Fe-2S и гемом bL вблизи внешней (out) стороны мембраны, обращённой в межмембранное пространство. В этом кармане связывается восстановленный убихинон (QH2). Другой, Qin-карман, предназначен для связывания окисленного убихинона (Q) и расположен вблизи внутренней (in) стороны мембраны, контактирующей с матриксом. 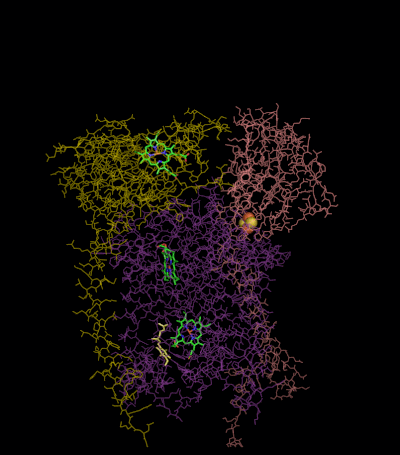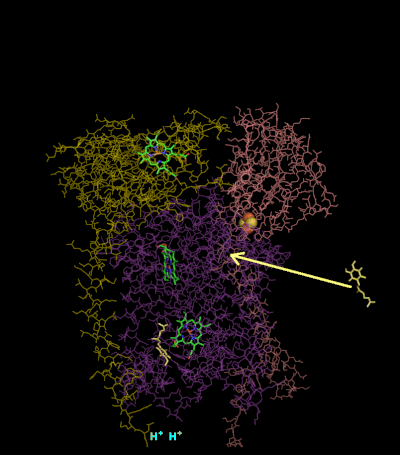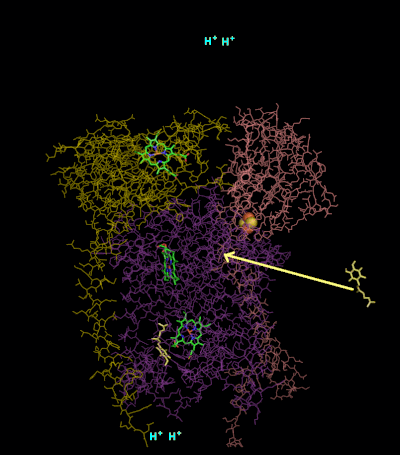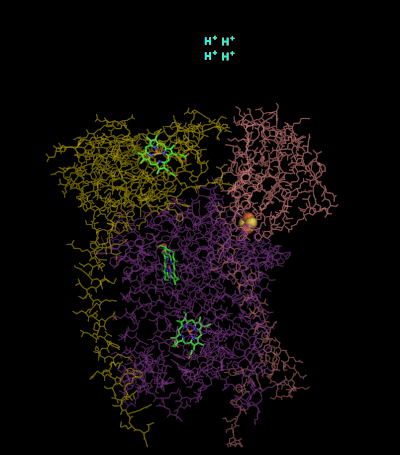 Первая часть Q-цикла
Вторая часть Q-цикла
Необходимым и парадоксальным условием работы Q-цикла является тот факт, что время жизни и состояние семихинонов в двух центрах связывания разное. В Qout-центре Q• нестабилен и действует как сильный восстановитель, способный отдать е- на низкопотенциальный гем by. В Qin-центре образуется относительно долгоживущий Q•−, потенциал которого позволяет ему действовать в качестве окислителя, принимая электроны с гема bH. Ещё один ключевой момент Q-цикла связан с расхождением двух электронов, входящих в комплекс, по двум разным путям. Изучение кристаллической структуры комплекса показало, что позиция 2Fe-2S-центра относительно других редокс-центров может смещаться. Оказалось, что белок Риске имеет подвижный домен, на котором собственно и расположен 2Fe-2S-кластер. Принимая электрон и восстанавливаясь, 2Fe-2S-центр меняет своё положение, отдаляясь от Qout-центра и гем bL на 17 Å с поворотом на 60° и тем самым приближаясь к цитохрому c. Отдав электрон цитохрому, 2Fe-2S-центр, наоборот, сближается с Qout-центром для установления более тесного контакта. Таким образом, функционирует своеобразный челнок (шаттл), гарантирующий уход второго электрона на гемы bL и bH. Пока это единственный пример, когда электронный транспорт в комплексах связан с подвижным доменом в структуре белка[15]. Активные формы кислородаНебольшая часть электронов покидает цепь переноса до того как достигнет Комплекса IV. Постоянные утечки электронов на кислород приводят к образованию супероксида. Эта небольшая побочная реакция приводит к образованию целого спектра активных форм кислорода, которые весьма токсичны и играют значительную роль в развитии патологий и старении (см. свободнорадикальная теория старения)[16]. Электронные протечки в основном происходят в Qin-сайте. Этому процессу способствует антимицин A. Он блокирует гемы b в их восстановленном состоянии не давая им сбросить электроны на семихинон Q•, что в свою очередь приводит к повышению его концентрации. Семихинон реагирует к кислородом, что и приводит к образованию супероксида. Образовавшийся супероксид поступает в митохондриальный матрикс[17][18] и межмембранное пространство, откуда он может попасть в цитозоль[17][19]. Этот факт можно объяснить тем, что Комплекс III, возможно, производит супероксид в форме незаряженного HOO•, которому легче проникнуть сквозь внешнюю мембрану по сравнению с заряженным O2•-[18]. Ингибиторы Комплекса IIIВсе ингибиторы Комплекса III можно разделить на три группы:
Некоторые из этих веществ используются как фунгициды (например, производные стробилурина, наиболее известным из которых является азоксистробин, ингибитор сайта Qout) и противомалярийные препараты (атовакуон)[20]. Мутации в генах Комплекса III и связанные с ними заболеванияМутации в генах Комплекса III обычно приводят к непереносимости физических упражнений[21][22]. Другие мутации могут вызывать септо-оптическую дисплазию[23] и мультисистемные расстройства[24]. Мутации в гене BCS1L, ответственном за правильное созревание Комплекса III, может привести к синдрому Бьёрнстада и синдрому GRACILE, который приводит к смерти в раннем возрасте. Фенотип многих из этих, а также других мутаций удалось оценить на таких системах как дрожжи[25]. В какой степени эти патологии вызваны биоэнергетической недостаточностью, а в какой избыточным образованием активных форм кислорода, на данный момент неизвестно. Галерея
См. также
Примечания
Литература
Ссылки
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
![Структура митохондриальной убихинол-цитохром с-оксидоредуктазы в комплексе с убихиноном[1].](http://upload.wikimedia.org/wikipedia/commons/thumb/7/70/Cytochrome1ntz.PNG/250px-Cytochrome1ntz.PNG)