|
Тканевая трансглутаминаза
Тканевая трансглутаминаза (сокр. тТГ, tTG или TG2) — кальцийзависимый фермент (КФ 2.3.2.13), из семейства трансглутаминазы (класс трансферазы), представляет собой белок состоящий из 687 аминокислот и молекулярной массой ~77,33 кДа[1][2][3]. Подобно другим трансглутаминазам, она сшивает белки между ε-аминогруппой остатка лизина и γ-карбоксамидной группой остатка глутамина, создавая меж- или внутримолекулярные ковалентные связи, которые обладают высокой устойчивостью к протеолизу (расщеплению белка). Помимо своей функции сшивания, тканевая трансглутаминаза катализирует другие типы реакций, включая дезамидирование, связывание молекул GTP/гидролиз и активность изопептидазы[4]. В отличие от других представителей семейства трансглутаминаз, тТГ может быть обнаружена как во внутриклеточном, так и во внеклеточном пространстве различных типов тканей, а также во многих различных органах, включая сердце, печень и тонкий кишечник. Внутриклеточный тип тТГ в изобилии содержится в цитозоле, но в меньших количествах её также можно обнаружить в ядре и митохондриях[2]. Считается, что внутриклеточный тип тТГ играет важную роль в апоптозе[5]. Во внеклеточном пространстве тТГ связывается с белками внеклеточного матрикса (ECM), особенно плотно связываясь с фибронектином[6]. Внеклеточный тип тТГ был связан с клеточной адгезией, стабилизацией ECM, заживлением ран, передачей сигналов рецепторам, клеточной пролиферацией и подвижностью клеток[2]. тТГ является аутоантигеном при целиакии, заболевания носящей пожизненный характер, при котором потребление диетического глютена вызывает патологический иммунный ответ, приводящий к воспалению слизистой тонкой кишки и последующей атрофии ворсинок[7][8][9]. Тканевая трансглутаминаза также была вовлечена в патофизиологию многих других заболеваний, включая такие, как множество различных видов злокачественных опухолей и нейрогенеративных заболеваний[10]. СтруктураГенУ человека, ген, кодирующий данный белок — TGM2, расположен на длинном плече (q-плече) 20-й хромосоме (20q11.2-q12). БелокТканевая трансглутаминаза — многофункциональный фермент, относящийся к трансглутаминазам, которые катализируют сшивание белков образуя ε-(гамма-глутамил) лизиновые псевдопептидные связи[11]. Подобно другим трансглутаминазам, тТГ состоит из сайта связывания GTP/GDP, каталитического домена, двух бета-цилиндров и бета-сэндвича[12]. Кристаллические структуры тТГ со связанными молекулами GDP, GTP или ATP продемонстрировали, что эти формы тТГ принимают "закрытую" конформацию, принимая во внимание, что тТГ с активным центром, занятым ингибирующим пептидом, имитирующим глютен, или другими подобными ингибиторами, принимает "открытую" конформацию[13][14][15]. В открытой конформации четыре домена тТГ расположены в вытянутой конфигурации, что обеспечивает каталитическую активность, тогда как в закрытой конформации два C-концевых домена свёрнуты на домене каталитического ядра, который включает остаток Cys-277[16]. N-концевой домен демонстрирует лишь незначительные структурные изменения между двумя различными конформациями[17]. Механизм катализаКаталитический механизм сшивки тТГ человека включает тиоловую группу (-SH) из остатка цистеина Cys в активном центре данного фермента[2]. Тиоловая группа атакует карбоксамид остатка глутамина на поверхности белкового или пептидного субстрата, высвобождая аммиак и образуя промежуточный тиоэфир. Затем промежуточный тиоэфир может быть атакован поверхностным амином второго субстрата (обычно из остатка лизина). Конечным продуктом реакции является стабильная псевдопептидная связь между двумя субстратами (т.е. поперечная сшивка). В качестве альтернативы, промежуточный тиоэфир может быть гидролизован, что приводит к полному превращению остатка глутамина в глутаминовую кислоту (т.е. к дезамидированию)[2]. Считается, что дезамидирование остатков глутамина, катализируемое тТГ, связано с патологическим иммунным ответом на молекулы глютена при целиакии[8]. Схема реакций сшивания и дезамидирования представлена на рисунке 1. 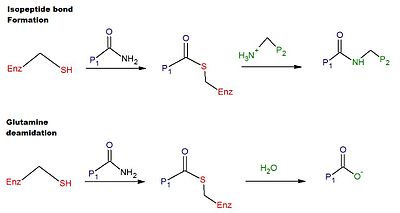 РегуляцияЭкспрессия тТГ регулируется на уровне транскрипции в зависимости от сложных сигнальных каскадов. После синтеза большая часть белка обнаруживается в цитоплазме, плазматической мембране и внеклеточного матрикса (ECM), но небольшая часть транслоцируется в ядро, где он участвует в контроле собственной экспрессии посредством влияния на регуляцию факторов транскрипции[18]. Сшивающая активность тТГ требует связывания ионов кальция Ca2+[19]. Множество ионов Ca2+ может связываться с одной молекулой тТГ[2]. В частности, тТГ способна связать до 6 ионов кальция на 5 различных сайтах связывания. Мутации, затрагивающие данные сайты связывания, вызывают снижение сродства (аффиности) к кальцию, снижают каталитическую активность фермента. Напротив, связывание одной молекулы GTP или GDP ингибирует сшивающую активность фермента[10]. Таким образом, внутриклеточный тип тТГ в основном неактивен из-за относительно высокой концентрации GTP/GDP и низкого уровня ионов кальция внутри клетки[2][8]. Хотя ожидалось, что внеклеточный тип тТГ будет активным из-за низкой концентрации гуаниновых нуклеотидов и высокого уровня кальция во внеклеточном пространстве, данные показали, что внеклеточный тип тТГ в основном неактивен[2][8][19]. Недавние исследования предполагают, что внеклеточный тТГ остаётся неактивным за счёт образования дисульфидной связи между двумя вицинальными (соседними) остатками цистеина, а именно Cys-370 и Cys-371[20]. Когда образуется эта дисульфидная связь, фермент остаётся в открытом состоянии, но становится каталитически неактивным[20]. Процесс окисления/восстановления дисульфидной связи служит третьим аллостерическим регуляторным механизмом (наряду с GTP/GDP и Ca2+) для активации тТГ[8]. Было показано, что тиоредоксин-1 активирует внеклеточный тип тТГ путём восстановления дисульфидной связи[19]. В молекулах тТГ может образовываться другая дисульфидная связь между остатками Cys-230 и Cys-370. Хотя эта связь не существует в нативном состоянии фермента, она появляется, когда фермент инактивируется путём окисления[16]. Присутствие ионов кальция защищает от образования обеих дисульфидных связей, тем самым делая фермент более устойчивым к окислению[16].  Недавние исследования показали, что интерферон γ может служить активатором внеклеточного типа тТГ в тонком кишечнике; эти исследования имеют прямое отношение к патогенезу целиакии[8]. Было показано, что активация тТГ сопровождается значительными конформационными изменениями, переходом от компактной (неактивной) к вытянутой (активной) конформации. (см. рисунок 3)[13][19][21].  Во внеклеточном матриксе тТГ "выключена", главным образом, из-за окислительной активности белка 57 эндоплазматического ретикулума (ERp57)[20]. Таким образом, тТГ аллостерически регулируется двумя отдельными белками, Erp57 и TRX-1[20]. (см. рисунок 4).  ФункциитТГ экспрессируется во всех тканях и присутствует в различных клеточных компартментах, таких как цитозоль, ядро и плазматическая мембрана[10]. В качестве кофактора, ферменту для катализа реакции трансамидирования требуются ионы кальция (Ca2+). Транскрипция фермента усиливается ретиноевой кислотой. Среди многих предполагаемых функций она (тТГ), по-видимому, играет роль в заживлении ран, апоптозе и развитии внеклеточного матрикса[7], а также в дифференцировке и клеточной адгезии[10]. Было отмечено, что тТГ может иметь очень разную активность в различных типах клеток. Например, в нейронах тТГ поддерживает выживание клеток, подвергшихся повреждению; тогда как в астроцитах подавление экспрессии гена тТГ полезно для выживания клеток[22]. Считается, что тТГ участвует в регуляции цитоскелета путём перекрёстного связывания различных белков цитоскелета, включая миозин, актин и спектрин[23]. Данные показывают, что внутриклеточный тип тТГ поперечно связывается с миозином. Также считается, что тТГ может стабилизировать структуру умирающих клеток во время апоптоза путём полимеризации компонентов цитоскелета, тем самым предотвращая утечку клеточного содержимого во внеклеточное пространство[4]. тТГ также обладает ГТФазной активностью:[1] В присутствии молекул GTP предполагается, что она функционирует как G-белок, участвующий в процессах передачи сигналов[24]. Предполагается, что помимо своей трансглутаминазной активности тТГ также действует как киназа[25], протеиндисульфидизомераза[26] и дезамидаза[27]. Последняя активность важна для дезамидирования пептидов глиадина, таким образом играя важную роль в патогенезе глютеновой энтеропатии. тТГ также проявляет активность протеиндисульфидизомеразы (PDI)[28][29]. Основываясь на своей активности PDI, тТГ играет важную роль в регуляции протеостаза, катализируя тримеризацию молекул HSF1 (фактор теплового шока 1) и, таким образом, реакцию организма на тепловой шок. При отсутствии тТГ реакция на тепловой шок нарушается, поскольку не образуется необходимый тример[29]. Клиническое значениетТГ является наиболее всесторонне изученной трансглутаминазой и ассоциируется со многими заболеваниями. Однако ни одно из этих заболеваний не связано с дефицитом ферментов. Действительно, до сих пор ни одно заболевание не было связано с отсутствием активности тТГ, и это было подтверждено исследованием мышей с нокаутом гена тТГ[30]. ЦелиакиятТГ наиболее известна своей связью с целиакией[9]. Впервые она был связана с патогенезом целиакии в 1997 году, когда было обнаружено, что фермент является антигеном, распознаваемым антителами, специфичными для этого заболевания. Антитела к трансглутаминазе приводят к форме чувствительности к глютену, при которой клеточный ответ на глютен пшеницы, поперечно сшитый ферментом, способен стимулировать специфические для трансглутаминазы В-клеточные реакции, которые в конечном итоге приводят к выработке антител IgA и IgG к трансглутаминазе[31][32]. Тканевая трансглутаминаза специфически дезамидирует остатки глутамина, создавая эпитопы, которые увеличивают сродство связывания пептида глютена с антигенпрезентирующими Т-клетками, инициируя адаптивный иммунный ответ[30]. Злокачественные опухолиНедавние исследования показывают, что тТГ также играет определённую роль в воспалении и биологии опухоли[7]. Экспрессия тТГ повышена во многих типах раковых клеток и связана с лекарственной устойчивостью и метастазированием из-за её способности способствовать мезенхимальному переходу и свойствам, подобным стволовым клеткам. В своей форме, связанной с GTP, тТГ способствует выживанию злокачественных опухолевых клеток и, по-видимому, является фактором, способствующим развитию рака. тТГ повышается в малигнизированных клетках и тканях при многих типах рака, включая лейкемию, рак молочной железы, рак предстательной железы, рак поджелудочной железы и рак шейки матки. Более высокая экспрессия тТГ также коррелирует с более частыми случаями метастазирования, резистентностью к химиотерапии, более низкой выживаемостью и в целом плохим прогнозом. Злокачественные опухолевые клетки могут быть уничтожены повышением уровня кальция за счёт повышения активности реакции трансамидирования, катализируемой тТГ. Доклинические испытания показали перспективность использования ингибиторов тТГ в качестве противоопухолевых терапевтических средств[33]. Однако в других исследованиях[28] было отмечено, что активность трансамидирования тТГ может быть связана с ингибированием инвазивности опухолевых клеток. Другие заболеванияСчитается, что тТГ способствует развитию нескольких нейродегенеративных расстройств, включая болезни Альцгеймера, Паркинсона и Хантингтона, влияя на транскрипцию, дифференцировку, миграцию и адгезию[34][35]. Такие неврологические заболевания частично характеризуются аномальной агрегацией белков из-за повышенной активности образования поперечных сшивок белков в поражённом мозге. Кроме того, было обнаружено, что специфические белки, связанные с этими нарушениями, являются субстратами тТГ in vivo и in vitro[4]. Хотя концентрация тТГ повышается в областях мозга, поражённых болезнью Гентингтона, недавнее исследование показало, что повышение уровня фермента не влияет на начало и/или прогрессирование заболевания у мышей[36]. Недавние исследования показывают, что тТГ может не быть вовлечён в развитие болезни Альцгеймера, поскольку исследования показывают, что она связана с лизисом эритроцитов и является следствием заболевания, а не его причиной. тТГ также была связана с патогенезом фиброза в различных органах, включая лёгкие и почки. В частности, при фиброзе почек тТГ способствует стабилизации и накоплению ECM, влияющего на активность TGF бета[12]. ДиагностикаСерологический анализ на антитела к тТГ заменил более старые серологические тесты (антиэндомизий, антиглиадин и антиретикулин) и обладает высокой чувствительностью (99 %) и специфичностью (>90 %) для выявления целиакии. Современные тесты на антитела к тТГ основаны на человеческом рекомбинантном белке в качестве антигена[37]. Терапевтический потенциалИспользование тТГ в качестве хирургического клея все ещё является экспериментальным. Она также изучается как ослабитель (аттенуатор) метастазирования в некоторых опухолях[7]. тТГ перспективен в качестве потенциальной терапевтической мишени для лечения фиброза сердца благодаря активности высокоселективного ингибитора тТГ[38]. Также было показано, что ингибиторы тТГ подавляют образование токсичных включений, связанных с нейродегенеративными заболеваниями[39]. Это указывает на то, что ингибиторы тТГ также могут служить инструментом для смягчения прогрессирования заболеваний головного мозга, связанных с тТГ[39]. ВзаимодействиятТГ участвует как в ферментативных, так и в неферментативных взаимодействиях. Между тТГ и её субстратными белками, содержащими донорные группы глутамина и лизина, в присутствии кальция формируются ферментативные взаимодействия. Известно, что субстраты тТГ влияют на её активность, что позволяет ферменту впоследствии выполнять разнообразные биологические функции в клетке. Однако важность неферментативных взаимодействий в регуляции активности тТГ ещё предстоит выявить. Недавние исследования показывают, что неферментативные взаимодействия играют физиологическую роль и обеспечивают различные функции тТГ в зависимости от контекста[40]. См. такжеПримечания
Ссылки
|
||||||||||||||||||||||||||||||||||||||||
