|
Динамика белков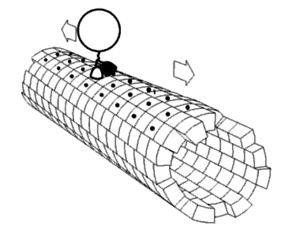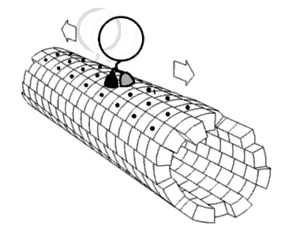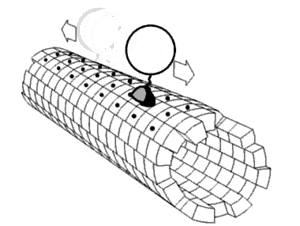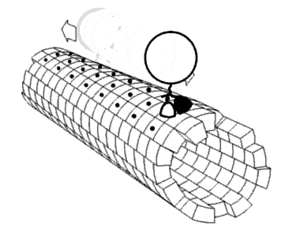 Считается, что белки имеют уникальные структуры, определяемые их аминокислотными последовательностями. Однако белки не являются строго статическими объектами, а скорее представляют ансамбли (иногда похожие) конформаций. Переходы между этими состояниями происходят в различных масштабах длины (от десятых Å до нм) и временных масштабах (от нс до с) и связаны с функционально значимыми явлениями, такими как аллостерическая передача сигналов[1] и ферментативный катализ[2]. Изучение динамики белков наиболее непосредственно связано с переходами между этими состояниями, но также может включать природу и равновесные популяции самих состояний. Эти две точки зрения — кинетика и термодинамика соответственно — могут быть концептуально синтезированы в парадигме «энергетического ландшафта»[3]: распространённые состояния и кинетика переходов между ними может быть описана глубиной энергетических ям и высотой энергетических барьеров, соответственно. Локальная гибкость: атомы и аминокислотные остаткиЧасти белковых структур часто отклоняются от состояния равновесия. Некоторые из таких отклонений являются гармоническими, например, стохастические колебания химических связей и валентных углов. Другие являются ангармоническими, например, боковые цепи, которые прыгают между отдельными дискретными минимумами энергии, или ротамеры[4]. Доказательства локальной гибкости часто получают с помощью ЯМР-спектроскопии. Гибкие и потенциально неупорядоченные области белка можно обнаружить с помощью индекса случайной катушки[англ.]. Гибкость свернутых белков можно определить путем анализа спиновой релаксации[англ.] отдельных атомов в белке. Гибкость также можно наблюдать на картах электронной плотности с очень высоким разрешением, созданных с помощью рентгеновской кристаллографии[5] особенно когда дифракционные данные собираются при комнатной температуре вместо традиционной криогенной температуры (обычно около 100 К)[6]. Информация о частотном распределении и динамике локальной гибкости белка может быть получена с помощью рамановской спектроскопии и оптической спектроскопии эффекта Керра в терагерцевой частотной области[7]. Региональная гибкость: внутридоменное соединение с несколькими остатками Многие остатки в белковых структурах находятся в непосредственной пространственной близости. Это верно для большинства остатков, которые являются смежными в первичной последовательности, но также и для многих остатков, которые являются дистальными по последовательности, но вступают в контакт в окончательной складчатой структуре. Из-за этой близости энергетические ландшафты этих остатков становятся связанными на основе различных биофизических явлений, таких как водородные связи, ионные связи и ван-дер-ваальсовы взаимодействия (см. рисунок). Таким образом, переходы между состояниями для таких наборов остатков становятся коррелированными[8]. Это, пожалуй, наиболее очевидно для открытых петель, которые часто коллективно смещаются, принимая различные конформации в различных кристаллических структурах (см. рисунок). Однако сопряженная конформационная гетерогенность также иногда очевидна во вторичной структуре[9]. Например, последовательные остатки и остатки, смещенные на 4 в первичной последовательности, часто взаимодействуют в α-спиралях. Кроме того, остатки, смещенные на 2 в первичной последовательности, направляют свои боковые цепи к одной и той же стороне β-листов и достаточно близки для стерического взаимодействия, как и остатки на соседних нитях одного и того же β-листа. Некоторые из этих конформационных изменений индуцируются посттрансляционными модификациями структуры белка, такими как фосфорилирование и метилирование[9][10].  Когда эти связанные остатки образуют пути, связывающие функционально важные части белка, они могут участвовать в аллостерической передаче сигналов. Например, когда молекула кислорода связывается с одной субъединицей тетрамера гемоглобина, эта информация аллостерически распространяется на другие три субъединицы, тем самым повышая их сродство к кислороду. В этом случае сопряженная гибкость гемоглобина позволяет кооперативному связыванию кислорода, что является физиологически полезным, поскольку оно обеспечивает быструю кислородную нагрузку в ткани легких и быструю разгрузку кислородом в тканях, лишенных кислорода (например, в мышцах). Глобальная гибкость: несколько доменовНаличие нескольких доменов в белках дает большую гибкость и подвижность, что приводит к динамике белковых доменов[1]. Движения доменов могут быть выведены путем сравнения различных структур белка (как в базе данных молекулярных движений), или их можно непосредственно наблюдать с помощью спектров[11][12] измеренных с помощью спектроскопии спинового эха нейтронов. Они также могут быть предложены путем отбора проб в обширных траекториях молекулярной динамики[13] и анализа главных компонент[14]. Движение домена важно для:
Одно из самых крупных наблюдаемых перемещений домена — это «поворотный» механизм в пируватфосфатдикиназе. Фосфоинозитидный домен переключается между двумя состояниями, чтобы переместить фосфатную группу из активного центра нуклеотид-связывающего домена в фосфоенолпируватный/пируватный домен[22]. Фосфатная группа перемещается на расстояние 45 Å с движением домена на около 100 градусов вокруг единственного остатка. В ферментах замыкание одного домена на другой захватывает субстрат за счет индуцированной подгонки, позволяя реакции протекать контролируемым образом. Подробный анализ Герштейна привел к классификации двух основных типов движения домена; шарнир и ножницы[19]. Только относительно небольшая часть цепи, а именно междоменный линкер и боковые цепи претерпевают значительные конформационные изменения при перестройке домена[23]. Шарниры с помощью вторичных структурИсследование Хейворда[24] показало, что концы α-спиралей и β-листов во многих случаях образуют шарниры. Было обнаружено, что многие петли включают в себя два вторичных элемента конструкции, действующих как дверные петли, позволяя открывать и закрывать двери. Это может возникнуть, когда две соседние нити в β-листе, расположенные в одном домене, расходятся, когда они присоединяются к другому домену. Два результирующих конца затем образуют области изгиба между двумя доменами. Было обнаружено, что α-спирали, которые сохраняют свою сеть водородных связей при изгибе, ведут себя как механические шарниры, накапливая «упругую энергию», которая управляет закрытием доменов для быстрого захвата субстрата[24]. От спиральной до расширенной конформацииВзаимопревращение спиральных и протяженных конформаций на участке границы домена не является чем-то необычным. В кальмодулине торсионные углы изменяются для пяти остатков в середине домена, связывающего α-спираль. Спираль разделена на две почти перпендикулярные более мелкие спирали, разделенные четырьмя остатками удлиненной цепи[25][26]. Сдвиговые движенияСдвиговые движения включают в себя небольшое скользящее движение границ раздела доменов, контролируемое боковыми цепями аминокислот внутри границы раздела. Белки, демонстрирующие сдвиговые движения, часто имеют многоуровневую архитектуру: складывание вторичных структур. Междоменный линкер выполняет лишь роль удержания доменов в непосредственной близости. Движение домена и функциональная динамика в ферментахАнализ внутренней динамики структурно различных, но функционально подобных ферментов выявил общую взаимосвязь между расположением активного сайта и двух основных субдоменов белка. Фактически, для некоторых членов суперсемейства гидролаз каталитический центр расположен близко к границе раздела двух основных квазижестких доменов[13]. Такое позиционирование, по-видимому, является инструментом для поддержания точной геометрии активного сайта, в то же время обеспечивая заметную функционально ориентированную модуляцию фланкирующих областей в результате относительного движения двух субдоменов. Последствия для макромолекулярной эволюцииДанные свидетельствуют о том, что динамика белков важна для функционирования, например, для ферментативного катализа при DHFR, но также предполагается, что они облегчают приобретение новых функций в результате молекулярной эволюции[27]. Этот аргумент предполагает, что белки эволюционировали, чтобы иметь стабильные, в основном уникальные складчатые структуры, но неизбежная остаточная гибкость приводит к некоторой степени функциональной неразборчивости, которая может быть усилена/задействована/отклонена с помощью последующих мутаций. Однако растет понимание того, что внутренне неструктурированные белки довольно распространены в геномах эукариот[28] ставит под сомнение простейшую интерпретацию догмы Анфинсена: «последовательность определяет структуру (единую)». Фактически, новая парадигма характеризуется добавлением двух оговорок: «последовательность и клеточная среда определяют структурный ансамбль». Примечания
|