|
Альдолаза A
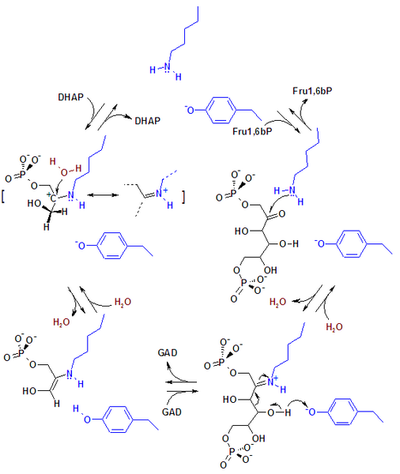
Альдолаза A, также фруктозо-бисфосфат альдолаза A или реже мышечный тип альдолазы (англ. Aldolase A, сокр. ALDOA) — фермент (КФ 4.1.2.13) из семейства фруктозо-1,6-бисфосфат альдолазы I класса (класс лиазы), является одним из трёх изоферментов (A, B и C). Альдолаза А играет ключевую роль в углеводном обмене: в глюконеогенезе и гликолизе в скелетных мышцах и эритроцитах. Фермент катализирует обратимую реакцию альдольного расщепления (негидролитического) и конденсации молекулы фруктозо-1,6-бисфосфата по реакции:
В результате альдольного расщепления фруктозо-1,6-бисфосфата, происходящего в процессе гликолиза, образуются два триозофосфата — дигидроксиацетонфосфат (ДАФ) и глицеральдегид-3-фосфат (ГАФ) соответственно, обратная реакция — альдольная конденсация приводит к образованию фруктозо-1,6-бисфосфата в глюконеогенезе. Экспрессия альдолазы А подавляется в печени, почках и кишечнике взрослых и аналогична уровням альдолазы C в мозге и других нервных тканях. Дефицит альдолазы А связан с миопатией и гемолитической анемией. Альтернативный сплайсинг и использование альтернативного промотора приводят к образованию множества вариантов транскрипта. Родственные псевдогены были идентифицированы на хромосомах 3 и 10[1]. Альдолаза A кодируется геном ALDOA, который у человека локализован на коротком плече (p-плече) 16-й хромосомы. СтруктураАльдолаза A представляет собой гомотетрамер и один из трёх изоферментов альдолазы (A, B и C), кодируемых тремя различными генами[2][3]. Ген ALDOA содержит 8 экзонов и 5'-UTR IB[3]. Идентифицированы ключевые аминокислоты, отвечающие за его каталитическую функцию. Остаток Tyr363 выполняет функцию кислотно-основного катализатора протонирования С3 субстрата, а Lys146, как предполагается, стабилизирует отрицательный заряд образующегося сопряжённого основания Tyr363 и напряжённую конфигурацию С-конца. Остаток Glu187 участвует во множестве функций, включая катализ альдолазой молекулы Ф-1,6-БФ, кислотно-основной катализ при связывании субстрата, дегидратацию и расщепление субстрата[4]. Хотя альдолаза А локализуется в ядре, у неё отсутствуют известные сигналы ядерной локализации[5]. ФункцииАльдолаза А — ключевой фермент четвёртой реакции гликолиза, а также обратной реакции в глюконеогенезе. Она катализирует обратимое превращение фруктозо-1,6-бисфосфата в глицеральдегид-3-фосфат и дигидроксиацетонфосфат путём альдольного расщепления связи C3-C4. В результате альдолаза является важнейшим участником биосинтеза АТФ[2][4][5][6][7]. ALDOA также участвует в других "подрабатывающих" функциях (минорных), таких как поддержание мышц, регуляция формы и подвижности клеток, сокращение поперечно-полосатых мышц, организация актинового цитоскелета и регуляция пролиферации клеток[2][5][6]. Альдолаза A, вероятно, регулирует ремоделирование актинового цитоскелета через взаимодействие с цитогезином-2 (ARNO) и Arf6[6]. Альдолаза A является убиквитарной и экспрессируется в большинстве тканей, но преимущественно в мышцах развивающегося эмбриона и взрослого человека[2][7]. В лимфоцитах ALDOA является преобладающей изоформой альдолазы[7]. Внутри клетки альдолаза А обычно локализуется в цитозоле, но может локализоваться и в ядре во время синтеза ДНК (S-фаза клеточного цикла). Эта ядерная локализация регулируется протеинкиназами AKT и p38. Предполагается, что ядро служит резервуаром для ALDOA в условиях низкого уровня глюкозы[5]. Фермент также обнаружен в митохондриях[7]. Альдолаза A регулируется субстратами энергетического метаболизма — глюкозой, лактатом и глутамином[5]. В тучных клетках (мастоцитах) человека, фермент подвергается посттрансляционной модификации путём нитрозирования молекул тирозина в белке, что может изменять его относительное сродство к Ф-1,6-БФ и/или к инозитолтрифосфату (ИФ3). Такое изменение сродства в дальнейшем влияет на сигнальные каскады ИФ3 и фосфолипазы C (PLC) в IgE-зависимых реакциях[7]. Механизм катализаВ альдолазе млекопитающих ключевыми каталитическими аминокислотными остатками, участвующими в реакции, являются лизин и тирозин. Тирозин выступает в качестве эффективного акцептора водорода, а лизин ковалентно связывает и стабилизирует интермедиаты (промежуточные продукты).
Клиническое значениеАльдолаза А (ALDOA) высоко экспрессируется в опухолевых клетках многих видов рака, включая плоскоклеточную карциному лёгкого (ПККЛ), рак почек и гепатоцеллюлярную карциному. Предполагается, что сверхэкспрессия ALDOA усиливает гликолиз в этих опухолевых клетках, способствуя их росту. В клетках плоскоклеточной карциномы лёгкого её повышение коррелирует с метастазированием и плохим прогнозом, а снижение — с уменьшением подвижности опухолевых клеток и снижением опухолевого генеза. Таким образом, ALDOA может быть потенциальным биомаркером ПККЛ и терапевтической мишенью для лекарственных препаратов[2]. Дефицит альдолазы А — редкое аутосомно-рецессивное заболевание, связанное с гемолизом и сопровождающееся слабостью, мышечными болями и миопатией[3]. Взаимодействия с белкамиПоказано, что альдолаза А взаимодействует с:
Примечания
Ссылки |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||