|
Азотистая кислота
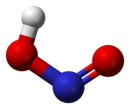
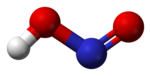
Азо́тистая кислота́ (химическая формула — HNO2) — слабая одноосновная высокотоксичная неорганическая кислота. При стандартных условиях неустойчива. СтроениеВ газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций: цис- и транс-. При комнатной температуре преобладает транс-изомер: эта структура является более устойчивой. Так, для цис-HNO2(г) ΔG°f = −42,59 кДж/моль, а для транс-HNO2(г) ΔG°f = −44,65 кДж/моль. Физические свойстваАзотистая кислота — это неустойчивая кислота, существующая только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Кислота весьма токсична (в больших концентрациях). Химические свойстваВ водных растворах существует равновесие: При нагревании раствора азотистая кислота распадается с выделением NO и образованием азотной кислоты: По действием щелочей образует соли, называемые нитритами (или азотистокислыми), которые гораздо более устойчивы, чем HNO2: HNO2 является слабой кислотой. В водных растворах диссоциирует (KD = 4,6⋅10−4), немного сильнее уксусной кислоты: Используется в органическом синтезе для получения органических нитритов (изопропилнитрита, изоамилнитрита и других). Реакция протекает в присутствии сильных кислот: Общая реакция: Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (пероксид водорода, хлор, перманганат калия) окисляется в азотную кислоту: В то же время она способна окислять вещества, обладающие восстановительными свойствами. Реакция с соляной кислотой при незначительном нагревании протекает обратимо, а при температуре выше +100°C идёт необратимо:
Может вступать в реакцию с азидами с образованием более безопасных продуктов, что является способом их утилизации: ПолучениеРастворение оксида азота(III) N2O3 в воде: Растворение оксида азота(IV) NO2 в воде: Применение
Физиологическое действиеАзотистая кислота (HNO2) весьма токсична, причём обладает ярко выраженным мутагенным действием, поскольку является дезаминирующим агентом. ПДК в рабочей зоне 5 мг/м3 (по диоксиду азота). Источники
Ссылки
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||









![{\displaystyle {\ce {HNO2 + HCl <=> [H2NO2]^+ + Cl- <=> NO+ + H2O + Cl-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7bd20e339014b02df96f7ad8d912394a711b9d69)

![{\displaystyle {\ce {HNO2 + R-OH ->[H^{+}] R-ONO + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/00badd9238a3a17241f25909924c6cc75e0c99da)






![{\displaystyle {\ce {2HNO_2\ + 2HCl ->[> +100^oC]Cl_2 ^ + 2NO ^ + 2H_2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/717bf56a68b106288561233bbfafb0f5a14f583e)


