|
Investimento parental O investimento parental, na biologia evolutiva e na psicologia evolucionista, é qualquer gasto parental (por exemplo, tempo, energia, recursos) que beneficie a prole.[1][2] O investimento parental pode ser realizado tanto por machos quanto por fêmeas (cuidado biparental), somente por fêmeas (cuidado materno exclusivo) ou somente por machos (cuidado paterno [en] exclusivo). O cuidado pode ser prestado em qualquer estágio da vida da prole, desde o pré-natal (por exemplo, guarda e incubação de ovos em aves e nutrição placentária em mamíferos) até o pós-natal (por exemplo, fornecimento de alimentos e proteção da prole). A teoria do investimento parental, um termo cunhado por Robert Trivers em 1972, prevê que o sexo que investe mais em sua prole será mais seletivo ao escolher um parceiro, e o sexo que investe menos terá uma competição intrassexual pelo acesso aos parceiros. Essa teoria tem sido influente na explicação das diferenças entre os sexos na seleção sexual e na seleção intersexual, em todo o reino animal e nos seres humanos.[2] História A seleção sexual é um conceito evolutivo que tem sido usado para explicar por que, em algumas espécies, os indivíduos do sexo masculino e feminino se comportam de forma diferente na seleção de parceiros. Em 1930, Ronald Fisher escreveu The Genetical Theory of Natural Selection,[3] no qual ele introduziu o conceito moderno de investimento parental, introduziu a hipótese do filho atraente [en] e introduziu o princípio de Fisher [en]. Em 1948, Angus John Bateman [en] publicou um estudo influente sobre moscas-das-frutas, no qual concluiu que, como a produção de gametas femininos é mais "cara" do que a de gametas masculinos, o sucesso reprodutivo das fêmeas era limitado pela capacidade de produzir óvulos e o sucesso reprodutivo dos machos era limitado pelo acesso às fêmeas.[4] Em 1972, Robert Trivers deu continuidade a essa linha de pensamento com sua proposta da teoria do investimento parental, que descreve como o investimento parental afeta o comportamento sexual. Ele conclui que o sexo com maior investimento parental será mais seletivo ao escolher um parceiro, e o sexo com menor investimento competirá intrassexualmente por oportunidades de acasalamento.[2] Em 1974, Trivers ampliou a teoria do investimento parental para explicar o conflito entre pais e filhos, o conflito entre o investimento que é ideal do ponto de vista dos pais e o da prole.[5] Cuidado parentalA teoria do investimento parental é um ramo da teoria de histórias de vida. A primeira consideração sobre o investimento dos pais foi feita por Ronald Fisher em seu livro de 1930, The Genetical Theory of Natural Selection,[6] no qual Fisher argumentou que o gasto dos pais com a prole de ambos os sexos deveria ser igual. Os machos da ferreirinha-comum tendem a não discriminar entre seus próprios filhotes e os de outro macho em sistemas poliândricos ou poliginândricos. Eles aumentam seu próprio sucesso reprodutivo alimentando a prole em relação ao seu próprio acesso à fêmea durante todo o período de acasalamento, o que geralmente é um bom indicador de paternidade.[7] Esse cuidado parental indiscriminado por parte dos machos também é observado em Ophioblennius atlanticus [en].[8]  Em alguns insetos, o investimento parental masculino é dado na forma de um presente nupcial. Por exemplo, as fêmeas de Utetheisa ornatrix recebem um espermatóforo contendo nutrientes, esperma e toxinas defensivas do macho durante a cópula. Esse presente, que pode representar até 10% da massa corporal do macho, constitui o investimento parental total que o macho fornece.[9] Em algumas espécies, como os seres humanos e muitos pássaros, a prole é altricial e incapaz de se defender por si mesma por um longo período de tempo após o nascimento. Nessas espécies, os machos investem mais em sua prole do que os pais machos de espécies precociais, pois, caso contrário, o sucesso reprodutivo seria prejudicado. Os benefícios do investimento parental para a prole são grandes e estão associados aos efeitos sobre a condição, o crescimento, a sobrevivência e, por fim, o sucesso reprodutivo da prole. Por exemplo, no peixe Tropheus moorii [en], uma fêmea tem um investimento parental muito alto em seus filhotes porque ela os alimenta com a boca e, enquanto o faz, toda a nutrição que ela ingere vai para alimentar os filhotes e ela efetivamente passa fome. Ao fazer isso, seus filhotes são maiores, mais pesados e mais rápidos do que seriam sem essa prática. Esses benefícios são muito vantajosos, pois reduzem o risco de serem comidos por predadores, e o tamanho geralmente é o fator determinante em conflitos por recursos.[10] Entretanto, esses benefícios podem ter um custo para a capacidade dos pais de se reproduzirem no futuro, por exemplo, por meio do aumento do risco de ferimentos ao defender a prole contra predadores, da perda de oportunidades de acasalamento durante a criação da prole e do aumento do intervalo de tempo até a próxima reprodução. Um caso especial de investimento parental é quando os filhotes precisam de nutrição e proteção, mas os pais genéticos não contribuem de fato com o esforço para criar seus próprios filhotes. Por exemplo, na abelha Bombus terrestris, muitas vezes as operárias estéreis não se reproduzem sozinhas, mas criam a ninhada da mãe. Isso é comum nos membros da ordem Hymenoptera devido à haplodiploidia, em que os machos são haploides e as fêmeas são diploides. Isso garante que as irmãs tenham mais parentesco umas com as outras do que com seus próprios descendentes, incentivando-as a ajudar a criar os filhotes da mãe em vez dos seus próprios filhotes.[11] De modo geral, os pais são selecionados para maximizar a diferença entre os benefícios e os custos, e o cuidado parental provavelmente evoluirá quando os benefícios excederem os custos. Conflitos entre pais e filhosA reprodução é dispendiosa. Os indivíduos são limitados no grau em que podem dedicar tempo e recursos para produzir e criar seus filhotes, e esse gasto também pode ser prejudicial à sua condição futura, à sobrevivência e à produção reprodutiva futura. Entretanto, esse gasto geralmente é benéfico para a prole, pois melhora sua condição, sobrevivência e sucesso reprodutivo. Essas diferenças podem levar a conflitos entre pais e filhos. Os pais são naturalmente selecionados para maximizar a diferença entre os benefícios e os custos, e o cuidado parental tende a existir quando os benefícios são substancialmente maiores do que os custos. Os pais têm o mesmo grau de parentesco com todos os descendentes e, portanto, para otimizar sua aptidão e a chance de reproduzir seus genes, eles devem distribuir seu investimento igualmente entre os descendentes atuais e futuros. No entanto, qualquer filhote é mais relacionado a si mesmo (tem 100% de seu DNA em comum com ele mesmo) do que a seus irmãos (os irmãos geralmente compartilham 50% de seu DNA), portanto, é melhor para a aptidão do filhote se o(s) pai(s) investir(em) mais nele. Para otimizar a aptidão, um pai deve investir em cada filhote igualmente, mas cada filhote deve querer uma parcela maior do investimento dos pais. O pai é selecionado para investir na prole até o ponto em que investir na prole atual é mais "caro" do que investir na prole futura.[12] Em espécies iteróparas, em que os indivíduos podem passar por várias tentativas de reprodução durante a vida, pode haver uma troca entre o investimento na prole atual e a reprodução futura. Os pais precisam equilibrar as demandas da prole com sua própria automanutenção. Esse possível efeito negativo do cuidado parental foi explicitamente formalizado por Trivers em 1972, que originalmente definiu o termo investimento parental como “qualquer investimento do pai em uma prole individual que aumente a chance de sobrevivência da prole (e, portanto, o sucesso reprodutivo) ao custo da capacidade do pai de investir em outras proles”.[2]  Os pinguins são um excelente exemplo de uma espécie que sacrifica drasticamente sua própria saúde e bem-estar em troca da sobrevivência de sua prole. Esse comportamento, que não necessariamente beneficia o indivíduo, mas o código genético do qual ele se origina, pode ser visto no pinguim-rei. Embora alguns animais apresentem comportamentos altruístas em relação a indivíduos que não são de parentesco direto, muitos desses comportamentos aparecem principalmente nas relações entre pais e filhos. Durante a reprodução, os machos permanecem em um período de jejum no local de reprodução por cinco semanas, esperando que a fêmea retorne para seu próprio turno de incubação. Entretanto, durante esse período, os machos podem decidir abandonar o ovo se a fêmea demorar a retornar ao local de reprodução.[13] Isso mostra que esses pinguins inicialmente fazem uma troca de sua própria saúde, na esperança de aumentar a sobrevivência do ovo. Mas chega um ponto em que os custos do pinguim macho se tornam muito altos em comparação com o ganho de uma temporada de reprodução bem-sucedida. Olof Olsson investigou a correlação entre o número de experiências em reprodução que um indivíduo tem e o tempo que ele espera até abandonar o ovo. Ele propôs que quanto mais experiente for o indivíduo, melhor ele será em reabastecer suas reservas corporais exauridas, permitindo que ele permaneça no ovo por um período de tempo mais longo.[13] O sacrifício do peso corporal e da possível sobrevivência dos machos para aumentar a chance de sobrevivência da prole é uma troca entre o sucesso reprodutivo atual e a sobrevivência futura dos pais.[13] Essa troca faz sentido com outros exemplos de altruísmo baseado em parentesco e é um exemplo claro do uso do altruísmo em uma tentativa de aumentar a aptidão geral do material genético de um indivíduo às custas da sobrevivência futura do indivíduo. Conflito entre mãe e filho no investimentoO conflito entre mãe e filho também foi estudado em espécies animais e em seres humanos. Um desses casos foi documentado em meados da década de 1970 pelo etólogo Wulf Schiefenhövel. As mulheres Eipo da Nova Guiné Ocidental se envolvem em uma prática cultural na qual dão à luz fora da aldeia. Após o nascimento do filho, cada mulher ponderava se deveria ou não ficar com a criança ou deixá-la no mato próximo, o que inevitavelmente terminava com a morte da criança.[14] A probabilidade de sobrevivência e a disponibilidade de recursos dentro da aldeia eram fatores que influenciavam essa decisão de ficar ou não com o bebê. Durante um destes partos, a mãe achou que a criança estava muito doente e não sobreviveria, então ela embrulhou a criança, preparando-se para deixá-la no mato; no entanto, ao ver a criança se mexendo, a mãe desembrulhou a criança e a levou para a aldeia, demonstrando uma mudança de vida e morte.[14] Esse conflito entre a mãe e a criança resultou em comportamentos de distanciamento no Brasil, vistos no trabalho de Scheper-Hughes como “muitos bebês do Alto permaneciam não apenas sem batismo, mas sem nome até começarem a andar ou falar”,[15] ou se surgisse uma crise médica e o bebê precisasse de um batismo de emergência. Esse conflito entre a sobrevivência, tanto emocional quanto física, provocou uma mudança nas práticas culturais, resultando em novas formas de investimento da mãe em relação à criança. Cuidado aloparentalO cuidado aloparental, também conhecido como “alomaternidade”, ocorre quando um membro de uma comunidade, além dos pais biológicos do bebê, participa da prestação de cuidados à prole.[16] Uma série de comportamentos se enquadra no termo cuidado aloparental, alguns dos quais são: carregar, alimentar, cuidar e proteger. Por meio do cuidado aloparental, o estresse sobre os pais, especialmente sobre a mãe, pode ser reduzido, diminuindo, portanto, os efeitos negativos do conflito entre pais e filhos sobre a mãe.[17] A aparente natureza altruísta do comportamento pode parecer contrária à teoria da seleção natural de Darwin, pois cuidar de filhos que não são seus não aumentaria sua aptidão direta, ao mesmo tempo em que tiraria tempo, energia e recursos da criação de seus próprios filhos. No entanto, o comportamento pode ser explicado evolutivamente como um aumento da aptidão indireta, já que a prole provavelmente será um parente não descendente e, portanto, carregará parte da genética do aloparental.[16] Direção da prole e da situaçãoO comportamento de investimento dos pais aumenta as chances de sobrevivência da prole e não exige que os mecanismos subjacentes sejam compatíveis com a empatia aplicável aos adultos ou com situações que envolvam prole não relacionada, e não exige que a prole retribua o comportamento altruísta de nenhuma forma.[18][19] Os indivíduos que investem nos pais não são mais vulneráveis a serem explorados por outros adultos. Teoria do investimento parental de Robert TriversO investimento parental, conforme definido por Robert Trivers em 1972,[20] é o investimento na prole pelo pai que aumenta as chances de sobrevivência da prole e, portanto, o sucesso reprodutivo às custas da capacidade do pai de investir em outros filhos. Um grande investimento dos pais diminui muito as chances de eles investirem em outros descendentes. O investimento parental pode ser dividido em duas categorias principais: investimento no acasalamento e investimento na criação. O investimento no acasalamento consiste no ato sexual e nas células sexuais investidas. O investimento na criação é o tempo e a energia gastos para criar a prole após a concepção. Na maioria das espécies, o investimento parental da fêmea nos esforços de acasalamento e criação supera em muito o do macho. Em termos de células sexuais (óvulos e espermatozoides), o investimento da fêmea normalmente é uma porção maior do material genético e da virilidade geral, enquanto os machos normalmente produzem milhares de espermatozoides diariamente. Trivers acreditava que essa teoria explicava o ciúme sexual [en].[20] Uma crítica à teoria vem da análise feita por Thornhill e Palmer em A Natural History of Rape: Biological Bases of Sexual Coercion, pois ela parece racionalizar o estupro e a coerção sexual.[21] Thornhill e Palmer alegaram que o estupro é uma técnica evoluída para obter parceiros em um ambiente em que as mulheres escolhem os parceiros. Como a teoria do investimento parental afirma que os machos procuram copular com o maior número possível de fêmeas férteis, a escolha que as mulheres têm poderia resultar em um efeito negativo sobre o sucesso reprodutivo do macho. Se as mulheres não escolhessem seus parceiros, Thornhill e Palmer afirmam que não haveria estupro. Isso ignora uma série de fatores socioculturais, como o fato de que não são apenas as mulheres férteis que são estupradas - 34% das vítimas de estupro menores de idade têm menos de 12 anos,[22] o que significa que elas não estão em idade fértil, portanto, não há vantagem evolutiva em estuprá-las. 14% dos estupros na Inglaterra são cometidos contra homens,[23] que não podem aumentar o sucesso reprodutivo de um homem, pois não haverá concepção. A teoria de Trivers não leva em conta o fato de as mulheres terem relacionamentos de curto prazo, como encontros de uma noite, e que nem todos os homens se comportam de forma promíscua. Uma explicação alternativa à teoria do investimento parental e às preferências de parceiros seria a teoria das estratégias sexuais de Buss e Schmitt.[24] Investimento parental humanoAs mulheres humanas têm um suprimento fixo de cerca de 400 óvulos, enquanto os espermatozoides dos homens são fornecidos a uma taxa de 12 milhões por hora.[25] Além disso, a fecundação e a gestação ocorrem nas mulheres, investimentos que superam o investimento do homem em um único espermatozoide eficaz. Além disso, para as mulheres, um ato de relação sexual pode resultar em um compromisso de 38 semanas de gestação humana e compromissos subsequentes relacionados à criação, como a amamentação. A teoria do investimento parental de Trivers traz várias implicações. A primeira implicação é que as mulheres são frequentemente, mas nem sempre, o sexo que mais investe. O fato de que elas costumam ser o sexo que mais investe leva à segunda implicação de que a evolução favorece as mulheres que são mais seletivas em relação a seus parceiros para garantir que a relação sexual não resulte em custos desnecessários. A terceira implicação é que, como as mulheres investem mais e são essenciais para o sucesso reprodutivo de sua prole, elas são um recurso valioso para os homens; como resultado, os homens geralmente competem pelo acesso sexual às mulheres. Machos como o sexo que mais investeEm muitas espécies, o único tipo de investimento masculino recebido é o das células sexuais. Nesses termos, o investimento feminino excede em muito o investimento masculino, conforme mencionado anteriormente. Entretanto, há outras maneiras pelas quais os machos investem em seus descendentes. Por exemplo, o macho pode encontrar alimento, como no exemplo das moscas.[26] Ele pode encontrar um ambiente seguro para a fêmea se alimentar ou botar seus ovos, como exemplificado em muitos pássaros.[27][28] Ele também pode proteger os filhotes e dar-lhes oportunidades de aprender quando jovens, como é o caso de muitos lobos. De modo geral, a principal função que os machos assumem é a de proteção da fêmea e dos filhotes. Isso geralmente pode diminuir a discrepância de investimento causada pelo investimento inicial das células sexuais. Em algumas espécies, como o grilo-mórmon, os machos investem mais. Entre as espécies em que o macho investe mais, o macho também é o sexo mais exigente, colocando maiores demandas na fêmea selecionada. Por exemplo, a fêmea que eles geralmente escolhem contém 60% mais ovos do que as fêmeas rejeitadas.[29] Política internacionalA teoria do investimento parental não é usada apenas para explicar fenômenos evolutivos e o comportamento humano, mas também descreve recorrências na política internacional. Especificamente, o investimento parental é mencionado ao descrever os comportamentos competitivos entre os Estados e determinar a natureza agressiva das políticas externas. A hipótese do investimento parental afirma que o tamanho das coalizões e a força física de seus membros do sexo masculino determinam se as atividades com os vizinhos estrangeiros são agressivas ou amistosas.[30] De acordo com Trivers, os homens tiveram investimentos parentais relativamente baixos e, portanto, foram forçados a situações de competição mais acirrada em relação a recursos reprodutivos limitados. A seleção sexual ocorreu naturalmente e os homens evoluíram para lidar com seus problemas reprodutivos exclusivos. Entre outras adaptações, a psicologia masculina também se desenvolveu para ajudar diretamente os homens nessa competição intrassexual.[30] Um dos desenvolvimentos psicológicos essenciais envolveu a tomada de decisão de fugir ou se envolver ativamente em uma guerra com outro grupo rival. Os dois principais fatores aos quais os homens se referiam nessas situações eram se a coalizão da qual faziam parte era maior do que a oposição e se os homens da coalizão tinham mais força física do que os outros. A psicologia masculina transmitida no passado antigo foi passada para os tempos modernos, fazendo com que os homens pensassem e se comportassem, em parte, como nas guerras ancestrais. De acordo com essa teoria, os líderes da política internacional não eram uma exceção. Por exemplo, os Estados Unidos esperavam vencer a Guerra do Vietnã devido à sua maior capacidade militar em comparação com seus inimigos. No entanto, a vitória, de acordo com a regra tradicional de maior tamanho da coalizão, não aconteceu porque os EUA não levaram em consideração outros fatores, como a perseverança da população local.[30] A hipótese do investimento parental sustenta que a força física masculina de uma coalizão ainda determina a agressividade dos conflitos modernos entre os Estados. Embora essa ideia possa parecer irracional quando se considera que a força física masculina é um dos aspectos menos determinantes da guerra atual, a psicologia humana evoluiu para operar com base nisso. Além disso, embora possa parecer que a motivação de busca de parceiros não seja mais determinante, nas guerras modernas a sexualidade, como o estupro, é inegavelmente evidente nos conflitos até os dias de hoje.[30] Seleção sexual Em muitas espécies, os machos podem produzir um número maior de descendentes ao longo de suas vidas, minimizando o investimento parental em favor de investir tempo engravidando qualquer fêmea em idade reprodutiva que seja fértil. Em contrapartida, uma fêmea pode ter um número muito menor de descendentes durante sua vida reprodutiva, em parte devido ao maior investimento parental obrigatório. As fêmeas serão mais seletivas (“exigentes”) em relação aos parceiros do que os machos, escolhendo machos com boa aptidão (por exemplo, genes, status elevado, recursos etc.), para ajudar a compensar qualquer falta de investimento parental direto do macho e, portanto, aumentar o sucesso reprodutivo. A teoria do investimento parental de Robert Trivers prevê que o sexo que faz o maior investimento em lactação, nutrição e proteção da prole será mais discriminatório no acasalamento; e que o sexo que investe menos na prole competirá por meio da seleção intrassexual pelo acesso ao sexo que investe mais.[31] Nas espécies em que ambos os sexos investem muito em cuidados parentais, espera-se que ocorra a escolha mútua. Um exemplo disso é visto nas tordas-de-penacho, em que os pais compartilham a mesma responsabilidade na incubação de seu único ovo e na criação do filhote. Nessa espécie, ambos os sexos são ornamentados.[32] Investimento parental de seres humanosOs seres humanos desenvolveram níveis crescentes de investimento parental, tanto biológica quanto comportamentalmente. O feto exige um alto investimento da mãe, e o recém-nascido altricial exige um alto investimento de uma comunidade. As espécies cujos filhotes recém-nascidos não conseguem se mover sozinhos e precisam de cuidados parentais têm um alto grau de altricialidade. As crianças humanas nascem incapazes de cuidar de si mesmas e precisam de investimento adicional dos pais após o nascimento para sobreviver.[33] Investimento maternoTrivers[2] formulou a hipótese de que um maior investimento biologicamente obrigatório prediz um maior investimento voluntário. As mães investem uma quantia impressionante em seus filhos antes mesmo de eles nascerem. O tempo e os nutrientes necessários para desenvolver o feto, bem como os riscos associados à administração desses nutrientes e ao parto, são um investimento considerável. Para garantir que esse investimento não seja em vão, é provável que as mães invistam em seus filhos após o nascimento, para garantir que eles sobrevivam e sejam bem-sucedidos. Em relação à maioria das outras espécies, as mães humanas dão mais recursos aos seus filhos, correndo um risco maior para sua própria saúde, mesmo antes do nascimento da criança. Esse fato está associado à evolução de uma história de vida mais lenta, na qual um número menor de descendentes maiores nasce em intervalos mais longos, exigindo maior investimento dos pais.[34][35] 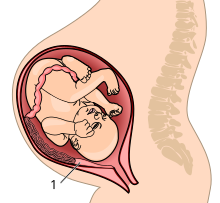 O feto humano em desenvolvimento - e especialmente o cérebro - precisa de nutrientes para crescer. Nas últimas semanas de gestação, o feto precisa de cada vez mais nutrientes à medida que o crescimento do cérebro aumenta.[36] Os roedores e primatas têm o fenótipo de placenta mais invasivo, a placenta hemocorial, na qual o córion erode o epitélio uterino e tem contato direto com o sangue materno. Os outros fenótipos de placenta são separados da corrente sanguínea materna por pelo menos uma camada de tecido. A placenta mais invasiva permite uma transferência mais eficiente de nutrientes entre a mãe e o feto, mas também apresenta riscos. O feto é capaz de liberar hormônios diretamente na corrente sanguínea da mãe para “exigir” mais recursos. Isso pode resultar em problemas de saúde para a mãe, como a pré-eclâmpsia. Durante o parto, o descolamento do córion da placenta pode causar sangramento excessivo.[37] O dilema obstétrico também torna o parto mais difícil e resulta em maior investimento materno. Os seres humanos desenvolveram o bipedalismo e o cérebro de grande porte. A evolução do bipedalismo alterou o formato da pelve e encolheu o canal de parto ao mesmo tempo em que o cérebro estava evoluindo para ser maior. A diminuição do tamanho do canal de parto fez com que os bebês nascessem mais cedo no desenvolvimento, quando tinham cérebros menores. Os seres humanos dão à luz bebês com cérebros 25% desenvolvidos, enquanto outros primatas dão à luz filhotes com cérebros 45-50% desenvolvidos.[38] Uma segunda explicação possível para o nascimento precoce em seres humanos é a energia necessária para crescer e sustentar um cérebro maior. A sustentação de um cérebro maior durante a gestação requer energia que a mãe talvez não consiga investir.[39] O dilema obstétrico torna o nascimento desafiador, e uma característica distintiva dos seres humanos é a necessidade de assistência durante o parto. A forma alterada da pelve bípede exige que os bebês saiam do canal do parto virados para o lado oposto ao da mãe, ao contrário de todas as outras espécies de primatas. Isso torna mais difícil para a mãe desobstruir as passagens de respiração do bebê, certificar-se de que o cordão umbilical não esteja enrolado no pescoço e puxar o bebê sem dobrar o corpo para o lado errado.[40] A necessidade humana de ter um acompanhante de parto também requer socialidade. Para garantir a presença de um acompanhante de parto, os seres humanos precisam se agregar em grupos. Há controvérsias sobre a alegação de que os seres humanos têm eussocialidade,[41] como as formigas e as abelhas, em que há um investimento parental relativamente alto, cuidado cooperativo dos jovens e divisão do trabalho. Não está claro o que evoluiu primeiro: a socialidade, o bipedalismo ou a assistência ao parto. Os bonobos, nossos parentes vivos mais próximos, ao lado dos chimpanzés, têm alta socialidade feminina e os nascimentos entre os bonobos também são eventos sociais.[42][43] A socialidade pode ter sido um pré-requisito para a assistência ao parto, e o bipedalismo e a assistência ao parto podem ter evoluído há cinco milhões de anos.[33]  À medida que as fêmeas primatas envelhecem, sua capacidade de reprodução diminui. A hipótese da avó descreve a evolução da menopausa, que pode ou não ser exclusiva dos humanos entre os primatas.[44] À medida que as mulheres envelhecem, os custos de investir em reprodução adicional aumentam e os benefícios diminuem. Na menopausa, é mais vantajoso interromper a reprodução e começar a investir nos netos. As avós têm certeza de sua relação genética com os netos, especialmente com os filhos de suas filhas, porque a certeza materna de seus próprios filhos é alta, e suas filhas também têm certeza de sua maternidade com seus filhos. Também foi teorizado que as avós investem preferencialmente nas filhas de suas filhas porque os cromossomos X carregam mais DNA e suas netas têm parentesco mais próximo com elas.[45] Investimento paternoÀ medida que a altricialidade aumentava, o investimento de outros indivíduos além da mãe se tornava mais necessário. A alta socialidade significava que os parentes do sexo feminino estavam presentes para ajudar a mãe, mas o investimento paterno também aumentou. O investimento paterno aumenta à medida que se torna mais difícil ter outros filhos e à medida que aumentam os efeitos do investimento sobre a aptidão da prole.[46] Os homens têm maior probabilidade do que as mulheres de não dar nenhum investimento parental aos filhos, e os filhos de pais com baixo investimento têm maior probabilidade de dar menos investimento parental aos seus próprios filhos. A ausência paterna é um fator de risco tanto para a atividade sexual precoce quanto para a gravidez na adolescência.[47][48][49][50] A ausência paterna aumenta os níveis de estresse dos filhos, que estão ligados ao início precoce da atividade sexual e ao aumento da orientação de acasalamento de curto prazo.[51][52][53][54][55] As filhas de pais ausentes têm maior probabilidade de buscar parceiros de curto prazo, e uma teoria explica isso como uma preferência por apoio social externo (não parceiro) devido à percepção de um futuro incerto e à disponibilidade incerta de parceiros comprometidos em um ambiente de alto estresse.[56] Investimento como indicador de estratégias de acasalamento Ovulação ocultaAs mulheres só podem engravidar durante a ovulação. A ovulação humana é oculta ou não é sinalizada externamente. A ovulação oculta diminui a certeza da paternidade porque os homens não têm certeza de quando as mulheres ovulam.[57] A evolução da ovulação oculta foi teorizada como resultado da altricialidade e do aumento da necessidade de investimento paterno - se os homens não têm certeza do momento da ovulação, a melhor maneira de se reproduzir com sucesso seria acasalar repetidamente com uma mulher durante todo o seu ciclo, o que exige a formação de pares, o que, por sua vez, aumenta o investimento paterno.[58] Orientações de acasalamentoA sociossexualidade [en] foi descrita pela primeira vez por Alfred Kinsey como uma disposição para se envolver em relacionamentos sexuais casuais e sem compromisso.[59] A orientação sociossexual descreve a sociossexualidade em uma escala que vai de irrestrita a restrita. Indivíduos com uma orientação sociossexual irrestrita têm maior abertura para o sexo em relacionamentos menos comprometidos, e indivíduos com uma orientação sociossexual restrita têm menor abertura para relacionamentos sexuais casuais.[60][61] Entretanto, hoje se reconhece que a sociossexualidade não existe na realidade em uma escala unidimensional. Os indivíduos menos abertos a relacionamentos casuais nem sempre estão buscando relacionamentos comprometidos, e os indivíduos menos interessados em relacionamentos comprometidos nem sempre estão interessados em relacionamentos casuais.[62] As orientações de acasalamento de curto e longo prazo são os descritores modernos de abertura para relacionamentos não comprometidos e comprometidos, respectivamente.[63] A teoria do investimento parental, conforme proposta por Trivers, argumenta que o sexo com maior investimento obrigatório será mais seletivo na escolha de parceiros sexuais, e o sexo com menor investimento obrigatório será menos seletivo e mais interessado em oportunidades de acasalamento “casual”. O sexo que investe mais não pode se reproduzir com a mesma frequência, fazendo com que o sexo que investe menos concorra por oportunidades de acasalamento.[20][64] Nos seres humanos, as mulheres têm maior investimento obrigatório (gravidez e parto) do que os homens (produção de esperma).[24] As mulheres têm maior probabilidade de ter orientações de acasalamento de longo prazo e os homens têm maior probabilidade de ter orientações de acasalamento de curto prazo.[62] As orientações de acasalamento de curto e longo prazo influenciam as preferências das mulheres em relação aos homens. Estudos descobriram que as mulheres dão grande ênfase à orientação profissional, à ambição e à devoção somente quando estão pensando em um parceiro de longo prazo.[65] Quando o casamento não está envolvido, as mulheres dão maior ênfase à atratividade física.[66] Em geral, as mulheres preferem homens que provavelmente farão um alto investimento parental e que tenham bons genes. As mulheres preferem homens com boa situação financeira, que sejam mais comprometidos, mais atléticos e mais saudáveis.[67] Algumas teorias imprecisas foram inspiradas pela teoria do investimento parental. A “hipótese da impotência estrutural”[68] propõe que as mulheres se esforçam para encontrar parceiros com acesso a altos níveis de recursos porque, como mulheres, elas são excluídas diretamente desses recursos. Entretanto, essa hipótese foi refutada por estudos que constataram que as mulheres bem-sucedidas financeiramente dão uma importância ainda maior ao status financeiro, ao status social e à posse de diplomas profissionais.[69] PoliginiaA diminuição da poliginia está associada ao aumento do investimento paterno.[70][71] Transição demográficaA transição demográfica descreve a diminuição moderna das taxas de natalidade e mortalidade. De uma perspectiva darwiniana, não faz sentido que famílias com mais recursos estejam tendo menos filhos. Uma explicação para a transição demográfica é o aumento do investimento parental necessário para criar filhos que poderão manter o mesmo nível de recursos que seus pais.[72] Veja tambémReferências
Leitura adicional
|
