|
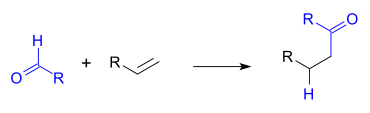
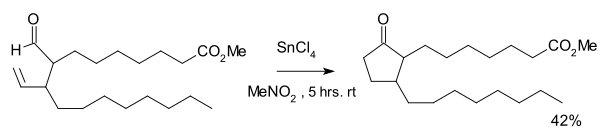
HidroacilaçãoHidroacilação é um tipo de reação orgânica no qual um aldeído é adicionado ao longo de uma cadeia de alceno ou alcino. O produto da reação é uma cetona. A reação requer um catalisador de metal e a reação intramolecular é favorecido sobre uma intermolecular. Com alcinos o produto da reação é uma cetona α,β-insaturada, incluindo a ciclopentenona.[1] A reação foi descoberta por K. Sakai em 1972 como parte de uma via de síntese para certos prostanóides, tendo como reagente o tetracloreto de estanho.[2] Com uma quantidade estequiométrica de catalisador de Wilkinson em clorofórmio, acetonitrila ou benzeno uma quantidade igual de um ciclopropano foi formada como o resultado de descarbonilação. A primeira aplicação catalítica foi relatada por Miller, em 1976 [3] na reação de 4-pentenal com o catalisador de Wilkinson para formar ciclopentanona. Nesta reação, o solvente foi saturado com etileno. A formação de anel ciclopentano é favorecida, sendo o produto da reação de 5-pentenal novamente uma ciclopentanona. Outro catalisador adequado é composto de ródio catiônico Rh(dppe)CIO4 (perclorado de dppe ródio). Mecanismo de reaçãoEm geral, um mecanismo de reação em um passo a hidroacilação é adição oxidativa de metal na ligação carbono-hidrogênio do aldeído seguida de adição “ao lado” do alceno, seguida pela eliminação redutiva.[1] Uma reação colateral é a descarbonilação do hidreto de metal acilo RCH2(CO)MH ao alcano RCH3 e M(CO) via o intermediário RCH2M(CO)H. Hidroacilação assimétricaHidroacilação como uma reação assimétrica foi demonstrada pela primeira vez por James e Young em 1983 (resolução cinética) [4][5] e por Sakai em 1989 (verdadeira síntese assimétrica) [6][7] tanto empregando ródio como um ligando difosfina quiral. Numa aplicação o ligando é Me-DuPHOS:[8] Referências
|