|
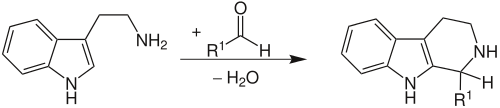
Pictet-Spengler-reactieDe Pictet-Spengler-reactie is een belangrijke organische reactie voor de synthese van alkaloïden en farmaceutische stoffen. Het is een condensatiereactie tussen een β-arylethylamine, zoals fenylethylamine of tryptamine, en een aldehyde of keton, waarbij ringvorming optreedt. Voor de reactie is in de regel een zuur als katalysator en verwarming nodig. De reactie werd ontdekt door Amé Pictet en Theodor Spengler aan de universiteit van Genève in 1911. Ze verwarmden β-fenylethylamine en dimethoxymethaan (het dimethylacetaal van formaldehyde) in aanwezigheid van zoutzuur. De twee verbindingen ondergingen een cycloadditiereactie met afsplitsing van water en vormden het alkaloïde 1,2,3,4-tetrahydro-isochinoline (THI).[1] De Pictet-Spengler-reactie kan beschouwd worden als een speciaal geval van de meer algemene Mannich-reactie. Ze kan uitgevoerd worden met een grote variëteit aan tryptamines, aldehyden en ketonen. Ze wordt beschouwd als de belangrijkste reactie voor de synthese van alkaloïden.[2] Biologische Pictet-Spengler-reactieIn 1977 ontdekte men dat de Pictet-Spengler-reactie ook in de natuur optreedt bij de biosynthese van alkaloïden. Daar wordt ze gekatalyseerd door enzymen, die men Pictet-Spenglerases noemt. Een voorbeeld is de biosynthese van morfine, waarin een enzym-gekatalyseerde Pictet-Spengler-reactie een sleutelrol speelt.[2] De eerste Pictet-Spenglerase die in de natuur ontdekt werd was strictosidinesynthase, dat de synthese katalyseert van strictosidine, een precursor van indoolalkaloïden zoals strychnine. Biologische Pictet-Spengler-reacties zijn stereoselectief: ze vormen een welbepaalde stereo-isomeer. De klassieke Pictet-Spengler-reactie is niet stereoselectief, tenzij er chirale katalysatoren gebruikt worden.[3] Bronnen, noten en/of referenties
|