 |
この項目では、医学における線維化(fibrosis)について説明しています。微生物学における線維化(filamentation)については「線維化」をご覧ください。 |
線維症(せんいしょう、英: fibrosis、線維化とも)は、正常な実質組織が結合組織に置き換わる病理学的な創傷治癒過程である[1][2]。治癒過程が抑制されずに継続された場合、組織の大規模なリモデリングと永久的な瘢痕組織の形成が引き起こされる[1]。線維性瘢痕化(せんいせいはんこんか、英: fibrotic scarring)としても知られる。
繰り返される損傷や慢性的な炎症とその修復は線維症になりやすく、コラーゲンなどの細胞外マトリックス成分の偶発的な過剰蓄積が線維芽細胞によって産生され、永久的な線維性瘢痕の形成につながる[1]。
損傷に対するこの反応は瘢痕化と呼ばれ、線維症が単一の細胞株から生じる場合は線維腫(英語版)(せんいしゅ、英: fibroma)と呼ばれる。生理学的には、線維化は結合組織を沈着させるように作用し、それは基礎にある臓器または組織の正常な構造および機能を妨害するか、完全に阻害する可能性がある。線維化は、治癒における結合組織の沈着プロセスと同様に、線維性組織の過剰な沈着の病理学的状態を説明するために使用される[3]。細胞外マトリックス(ECM)タンパク質の病理学的な蓄積によって定義される線維化は、瘢痕化と患部組織の肥厚をもたらすもので、本質的には、正常な臓器機能を妨げる過剰な創傷治癒反応である[4]。
生理学
線維化は、刺激された線維芽細胞がコラーゲンやグリコサミノグリカンなどの結合組織を形成することに関与する点で、瘢痕化のプロセスに似ている。このプロセスは、マクロファージなどの免疫細胞が線維芽細胞を刺激する可溶性因子を放出したときに開始される。最もよく特徴付けられる線維化促進メディエーターはTGF-βであり、これはマクロファージだけでなく、間質と呼ばれる表面間の損傷組織によって放出される。線維化の他の可溶性メディエーターには、CTGF(英語版)、血小板由来成長因子(PDGF)、およびインターロイキン-10(IL-10)が含まれる。これらは、AKT/mTOR[5]経路やSMAD[6]経路などのシグナル伝達経路を開始し、最終的に線維芽細胞の増殖と活性化につながり、細胞外マトリックスを周囲の結合組織に沈着させる。組織修復のこのプロセスは複雑であり、細胞外マトリックス(ECM)の合成と分解を厳密に制御することで、正常な組織構造が維持される。このプロセス全体は、必要なものではあるものの、組織損傷が重度または反復性である場合や創傷治癒反応自体の調節に異常が生じた場合には進行性の不可逆的な線維化反応を引き起こす可能性がある[4]。
解剖学的位置
線維化は、通常、炎症や損傷の結果として体内の多くの組織で発生する可能性があり、次の例が含まれる。
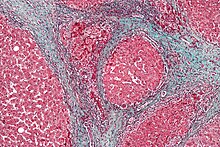 肝硬変を示す肝臓の顕微鏡写真。この例の組織は、繊維化が青色に着色されているトリクローム染色で染色されている。赤い部分は、結節性肝組織である。
肝硬変を示す肝臓の顕微鏡写真。この例の組織は、繊維化が青色に着色されているトリクローム染色で染色されている。赤い部分は、結節性肝組織である。
肺
肝臓
- ブリッジング線維症(英語版) - 進行性の慢性肝疾患で見られる進行期の肝線維化。「ブリッジング」という用語は、『ブリッジの形成(成熟した厚い繊維状組織のバンドによる)による中心静脈への門脈領域を閉塞する』ことを意味し、偽小葉の形成につながる。肝毒素(例:チオアセトアミド、四塩化炭素、ジエチルニトロサミン)の長期暴露は、実験動物モデルでブリッジング線維症(架橋線維症とも)をもたらす[7]。
 チオアセトアミドの6週間投与後のウィスターラットにおけるブリッジング線維症。シリウスレッド染色
チオアセトアミドの6週間投与後のウィスターラットにおけるブリッジング線維症。シリウスレッド染色
脳
心臓
心筋線維症には主に2つの形態がある。
- 間質性線維症 - 鬱血性心不全、高血圧、あるいは正常な加齢で説明される[8]
- 置換性線維症 - 高齢の心筋梗塞を示す
その他
脚注
- ^ a b c d Wynn, Thomas A. (2004). “Fibrotic disease and the TH1/TH2 paradigm”. Nature Reviews. Immunology (Springer Science and Business Media LLC) 4 (8): 583–594. doi:10.1038/nri1412. ISSN 1474-1733. PMC 2702150. PMID 15286725. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2702150/.
- ^ Birbrair, Alexander; Zhang, Tan; Files, Daniel C.; Mannava, Sandeep; Smith, Thomas; Wang, Zhong-Min; Messi, Maria L.; Mintz, Akiva et al. (2014-11-06). “Type-1 pericytes accumulate after tissue injury and produce collagen in an organ-dependent manner” (英語). Stem Cell Research & Therapy 5 (6): 122. doi:10.1186/scrt512. ISSN 1757-6512. PMC 4445991. PMID 25376879. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4445991/.
- ^ Glossary of dermatopathological terms. DermNet NZ
- ^ a b “Epigenetics and the overhealing wound: the role of DNA methylation in fibrosis”. Fibrogenesis & Tissue Repair 8: 18. (2015). doi:10.1186/s13069-015-0035-8. PMC 4591063. PMID 26435749. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4591063/.
- ^ “Dual mTOR Inhibition Is Required to Prevent TGF-β-Mediated Fibrosis: Implications for Scleroderma.”. J Invest Dermatol 135 (11): 2873–6. (2015). doi:10.1038/jid.2015.252. PMC 4640976. PMID 26134944. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4640976/.
- ^ “TGF-beta signaling and the fibrotic response”. FASEB Journal 18 (7): 816–827. (2004). doi:10.1096/fj.03-1273rev. PMID 15117886.
- ^ dwivedi, durgesh Kumar; Jena, Gopa Bandhu (Nov 2018). “Glibenclamide protects against thioacetamide-induced hepatic damage in Wistar rat: investigation on NLRP3, MMP-2, and stellate cell activation”. Naunyn-Schmiedeberg's Archives of Pharmacology 391 (11): 1257–1274. doi:10.1007/s00210-018-1540-2. PMID 30066023.
- ^ Chute, Michael; Aujla, Preetinder; Jana, Sayantan; Kassiri, Zamaneh (2019). “The Non-Fibrillar Side of Fibrosis: Contribution of the Basement Membrane, Proteoglycans, and Glycoproteins to Myocardial Fibrosis”. Journal of Cardiovascular Development and Disease 6 (4): 35. doi:10.3390/jcdd6040035. ISSN 2308-3425. PMC 6956278. PMID 31547598. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6956278/.
- ^ Duffield JS (June 2014). “Cellular and molecular mechanisms in kidney fibrosis”. J Clin Invest 124 (6): 2299–306. doi:10.1172/JCI72267. PMC 4038570. PMID 24892703. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4038570/.
外部リンク
 ウィキメディア・コモンズには、線維症に関するカテゴリがあります。
ウィキメディア・コモンズには、線維症に関するカテゴリがあります。




