心筋症 (しんきんしょう、英 : cardiomyopathy )は、心機能障害を伴う心筋 疾患をいう。心筋症は拡張型、肥大型、拘束型、不整脈原性右室心筋症に分類されるが、これらに分類できない分類不能型も存在する。
心筋症は数多くの名前で呼ばれてきたが、最初の解剖症例の報告は1891年 のクレールによるものとされる[ 1] 世界保健機関 (WHO) と国際心臓連合 (ISFC) の合同委員会は1980年心筋症を「原因不明の心筋疾患」 と定義し拡張型 (DCM, dilated cardiomyopathy)・肥大型 (HCM, hypertrophic cardiomyopathy)・拘束型 (RCM, restrictive cardiomyopathy) に分類し、心筋疾患でも原因または全身疾患との関連が明らかなものと厳密に区別した[ 2] 「心機能障害を伴う心筋疾患」 と広く定義し直し従来の3分類に加え、催不整脈性右室心筋症、特定心筋症の範疇を設けた[ 3]
心室とともにしばしば心房の内腔容積増加を伴う心拡大 (cardiac enlargement) と収縮機能障害を特徴とする心筋 の病気であり、不整脈による突然死と心不全をもたらす。初期には心拡大によってポンプ機能自体は正常範囲に保たれており、βブロッカー 、アンギオテンシン変換酵素阻害薬 あるいはアンギオテンシンII受容体ブロッカー 、利尿薬 などの薬の組み合わせにより進行を遅らせることが可能である。しかし、代償が破綻し末期重症心不全になると有効な治療薬はなく心臓移植を必要とする。女性より男性のほうが重篤な傾向がみられる。
日本では、特発性拡張型心筋症(とくはつせいかくちょうがたしんきんしょう、Idiopathic DCM)として特定疾患治療研究事業 対象疾患に指定されている。
初期段階では自覚症状があまりなく、易疲労感・倦怠感や動作時に軽い動悸が起こる程度であるため、発見が遅れてしまうケースがある。病状が進行すると浮腫 ・湿性咳嗽 ・頸静脈 怒張などの身体症状を伴う重篤な鬱血性心不全 や治療抵抗性の不整脈 を起こす。診断されてからの5年生存率は54%、10年生存率は36%とされていたが、最近では治療の進歩により5年生存率は76%と向上している[ 4] 突然死 もまれではない。激しい運動は心臓に大きな負担を強いることとなり、急な心臓発作を起こす可能性があるため避けるべきとされている。
心電図 ではP波の持続時間延長が認められる。
拡張型心筋症は、以前からウイルス、アルコール、毒物、免疫障害など非遺伝的攻撃によってもたらされることが知られていた。原因不明なものは“特発性”拡張型心筋症と呼ばれていたが、サルコメア 蛋白質、細胞骨格 蛋白質、筋形質膜および核膜 蛋白質の遺伝子の突然変異が拡張型心筋症の大きな原因であることが最新の研究で明らかにされている[ 5] サルコメア 蛋白質であるミオシン 、アクチン 、トロポニン 、トロポミオシン に関して、組換え変異蛋白質分子や遺伝子改変動物モデルを用いた研究が活発に行われている。ミオシン 変異はサルコメア の収縮機構そのものを傷害し(i.e.,アクチン -ミオシン 相互作用の低下をもたらす)、アクチン 、トロポニン 、トロポミオシン 変異は心筋収縮のカルシウムによる調節機構 を傷害する(i.e.,ミオフィラメントカルシウム感受性 の低下をもたらす)ことが明らかにされている[ 6] 細胞骨格 蛋白質と細胞膜貫通蛋白質の突然変異はサルコメア が発生する力の隣接心筋 細胞への伝達を傷害し、核膜 蛋白質の突然変異は心筋細胞に加わる力による遺伝子発現機構の傷害によって拡張型心筋症をもたらすのでないかと推測されている[ 7] 心筋 細胞には単にその収縮機能が内因的に低下するだけで心拡大によって代償するメカニズムがはじめからプログラムされているということである。皮肉なことに、その代償メカニズムが働くことによって致死的不整脈による突然死のリスクが高まり、その破綻によって末期心不全がもたらされるものと推測される。現在治療薬として用いられるβブロッカー 、アンギオテンシン変換酵素阻害薬 やアンギオテンシンII受容体ブロッカー は、短期的には収縮機能を高めるが長期的には有害な“細胞内cAMP とカルシウムの増加を介する”代償反応を抑えることでその破綻を遅らせているように見える。細胞内cAMP とカルシウムの増加によらず収縮機能を改善することができる新規の強心薬 であるカルシウム感受性増強薬やミオシン活性増強薬 などは、このような長期的には有害な代償反応プログラムの発動を抑えてより高い有効性を示すことが期待される[ 8] [ 9]
心臓移植
1967年 に世界で初めてヒトからヒトへの心臓移植が行われ、現在では安定した成果を示している。そのため、本疾患の根本治療とされる。内科的療法
近年、アンジオテンシン変換酵素阻害薬 (ACE阻害薬 )、アンジオテンシンII受容体拮抗薬 (ARB、AII拮抗薬)、ベータ遮断薬 などが適用され効果を挙げている。遠隔生存率も比較的高い。しかし、体質・症状の進行状態により上記の薬が期待した効果を挙げない場合もある。また、これらは根治療法ではなく進行を遅らせることしかできない。
補助人工心臓 の使用心臓移植までの症状維持を目的とする埋め込みと、心臓移植待機を目的とせず補助人工心臓を使い続けていく目的での埋め込みの2通りの治療が行われる。心臓移植までの症状維持としての補助人工心臓は2004年 に医療保険の適用となった。移植目的でなく補助人工心臓を使い続ける選択は、主に高齢のため手術に耐えうる体力がない患者に対してとられることが多い。補助人工心臓を使い続ける目的での世界初の手術は、1995年 10月にイギリス で高齢のため移植手術が行うことが困難とされた患者に施された。
左室形成術
左室形成術は、虚血性心筋症 や拡張型心筋症 などによる高度左室 機能不全を伴う慢性心不全 に対する手術 であり、左室容積を縮小させることにより心機能、生命予後 の改善を図ることを目的とする。補助人工心臓や心臓移植の前段階、あるいはその非適応症例に対して適応が考慮される治療法である[ 10]
遺伝子治療
現在は動物実験の段階である。ヒトへの治療が行われた症例は報告されていない。特発性拡張型心筋症の先天的原因を治癒しようという試みである。積極的治療法(心臓移植)を行うことが難しい患者への応用が期待されている。
心筋シート
患者自身の筋肉を5 - 10g程度摘出し、それを培養してシート状にして患部(左心室)に貼り付ける治療法。その心筋シートを用いて弱った心臓のポンプ機能を回復しようという試みである。動物実験ではポンプ機能が回復されることが確認されている。欧米ではすでに実施され、重篤な不整脈などの副作用が報告されている。日本国内では2007年5月、大阪大学の澤芳樹 教授によって骨格筋由来の筋芽細胞シートを開発、2015年9月に世界初の心不全治療用再生医療製品「ハートシート」の製造販売承認(条件期限付き)取得、2016年に販売を始めている[ 11]
次にiPS細胞 由来のヒト心筋シートが開発され、動物実験が実施された[ 11] [ 12] [ 13]
500人に1人が発症するよくある病気であり、若いアスリートなど若者の突然の心停止によくある原因である。男女差は見られない。
心筋細胞の肥大のため心室壁が厚くなるが心室のサイズはしばしば正常である。本症は心筋肥大による左心室 の拡張障害が主体である。拡張期が短縮することにより、心室に血液が充分に流れ込まなくなる。その結果、全身に流れる血液 量が不足したり、心室→心房への逆流が起こることによりひいては肺水腫 に至って呼吸困難 を呈したりする。病態が進行するとしばしば拡張型心筋症様になることがあり、拡張相肥大型心筋症と呼ばれる。
心房細動 の合併が多い。
大動脈弁 付近の壁肥厚による閉塞性肥大型心筋症 (HOCM) と、心尖部 の壁肥厚による非閉塞性肥大型心筋症 (HNCM) に分類される。HOCMの基本病態は、心流出路狭窄 による心拍出量低下 であり、一方、HNCMの基本病態は、心室筋肥大による左室拡張能の低下および不整脈である。欧米では前者が多いが、日本 では後者が比較的多い。また、肥大が心尖部に限局したapical HCM と呼ばれる病態も報告されている。初報告は日本でなされており、また日本人に多いとされている。
これらの研究の結果、現在では、心筋の異常な肥大こそがHCMの本質であり、各分類は、その肥大する部位の差によって、左室流出路狭窄が起きるか否かに過ぎないと認識されるようになっている。
閉塞性肥大型心筋症においては、下記のような所見が見られる。
聴診 胸骨左縁 第3、4肋間から心尖部を中心として、収縮期駆出性雑音、IV音を聴取する[ 14]
心電図 左室肥大、異常Q波、ST-T変化、巨大陰性T波(apical HCMの特徴)が見られる[ 14]
頚動脈波 二峰性脈(pulsus bisferiens:spike and dome型)が認められる。大動脈弁閉鎖不全症の二峰性脈とは異なる。急激な立ち上がりのあと、収縮中期から後期にゆるやかな2つ目の峰を形成する。
心エコー 非対称性心室中隔肥厚 (ASH)
僧帽弁前尖の収縮期前方運動 (SAM)
大動脈弁の収縮中期 半閉鎖
などが見られる。
心臓カテーテル検査 左室拡張末期圧 (LVEDP) の上昇が特徴的である。
左室流入路と流出路の収縮期圧較差(20mmHg以上)が認められる。
病理学検査
肥大した心筋細胞が見られる。これらの配列においては、樹枝状分枝や渦巻き状などの錯綜配列が特徴的である。錯綜配列は、肥大した心室中隔を中心に分布する。
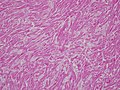
肥大型心筋症の病理組織写真(HE染色)。
肥大型心筋症の割面像。
通常は遺伝性であり、本症症例のおよそ7割が常染色体 優性遺伝 形式をとる遺伝子変異が原因である。拡張型心筋症 と同様にミオシン 、アクチン 、トロポニン 、トロポミオシン をはじめとするサルコメア 蛋白質の遺伝子 の突然変異が明らかにされている[ 5] カルシウムによる収縮制御 に関わるトロポニン やトロポミオシン 遺伝子の突然変異はミオフィラメントカルシウム感受性 を増加させる。これは、これらの遺伝子における拡張型心筋症 を引き起こす変異がカルシウム感受性を低下させることと逆であり、ミオフィラメントカルシウム感受性 増加による収縮機能の亢進あるいは弛緩機能の低下が肥大型心筋症をもたらしていると考えられる[ 7] [ 6]
最大の問題である、突然死の予防が最重点となる。
過激な運動を避け、また、心筋の拡張能を改善するためと、心筋の負荷を軽減するために、β遮断薬 が使われる。しかし、喘息 を合併している場合のようにβ遮断薬が禁忌 の症例にはカルシウム拮抗剤 などが用いられる。大動脈弁 狭窄や僧帽弁 逆流が高度な場合には、心室中隔切除術などの外科的手術を行う。場合によっては突然死予防のため植え込み型除細動器 が必要になる。
心室の収縮機能は正常だが左心室が硬く、拡張に問題がある。この点では肥大型心筋症と似ているが肥大や拡大等が見られない点で異なる。アクチン 、ミオシン 、トロポニン 遺伝子の突然変異が発症に関与していることがわかっている[ 5]
不整脈原性右室心筋症 は、遺伝的心筋変性疾患である。右心室心筋が脱落し、脂肪組織または線維脂肪組織が心筋を置換する[ 15] [ 16] 心室頻拍 などを合併し突然死を起こすことがある。
V1~V4でのイプシロン波 (ε波)や陰性T波がみられる。
上記4型のいずれにも分類されない。
たこつぼ心筋症
ストレス などにより、左室心尖部が収縮しなくなり、左室が「たこつぼ」のような形態を呈するもの。予後良好なものが多い。カテコラミン との関与が示唆されている。ストレス心筋症
幸せで悲しい出来事でも無差別に発生するストレスによって引き起こされる心筋症[ 17]
頻脈誘発性心筋症 - 明らかな基礎心疾患がなく,長期間続く頻脈によって左室収縮機能が低下し,頻脈の改善により収縮機能の改善をきたす疾患[ 18]
^ Krehl L. Beitrag zur Kenntnis der idiopathischen Herzumuskelerkrankungen. Dtsch Arch Klin Med 1891;48:414-431.
^ Report of WHO/ISFC taskforce on the definition and classification of cardiomyopathies. Brit Heart J 1980;44:672-673. PMID 7459150
^ Richardson P, et al. Report of the 1995 World Health Organization/International Society and Federation of Carrdiology task force on the definition and classification of cardiomyopathies. Circulation 1996;93:841-842. PMID 8598070
^ 難病情報センター | 特発性拡張型心筋症(指定難病57) ^ a b c Clinical Cardiogenetics, Baars, H.F.; van der Smagt, J.J. (Eds.) Springer, 2011.
^ a b Morimoto S. Sarcomeric proteins and inherited cardiomyopathies. Cardiovasc Res. 2008; 77: 659–666. PMID 18056765
^ a b Fatkin D, Graham RM. Molecular mechanisms of inherited cardiomyopathies. Physiol Rev 2002;82:945–980. PMID 12270949
^ R. John Solaro. Translational medicine with a capital T, troponin T, That is. Circulation Research, 2007; 101: 114-115. PMID 17641232
^ Teerlink et al., Dose-dependent augmentation of cardiac systolic function with the selective cardiac myosin activator, omecamtiv mecarbil: a first-in-man study. Lancet, 2011; 378(9792):667-675. PMID 21856480
^ 坂田隆造. 心臓外科 Knack & Pitfalls 冠動脈外科の要点と盲点 第2版. 文光堂. pp266-291. ISBN 978-4-8306-2336-3 .
^ a b 重症心不全治療用の筋芽細胞シートの実用化とiPS細胞由来心筋シートの開発 日本医療研究開発機構
^ “iPS心筋シート移植 冬に延期 大阪大、安全性を検証” . 産経新聞 . (2019年6月27日). https://www.sankei.com/article/20190627-ZBY5ZCV7D5M2HKS55KEW237SRM/ 2019年10月15日 閲覧。 ^ “ヒトiPS細胞由来心筋細胞シート移植では、CD8陽性T細胞主体的な 免疫拒絶反応が誘導される可能性がある” . 順天堂大学 . (2024年7月4日). https://www.juntendo.ac.jp/news/19162.html 2024年7月5日 閲覧。 ^ a b c 病気がみえるVol.2 メディックメディア社発行 P220 ISBN 978-4896323436
^ http://www.udatsu.vs1.jp/ARVC.htm ^ Thiene G et al:New Eng J Med 1988,318:129-133
^ Corliss, Julie (2022年8月1日). “Happy heart syndrome: Even positive stress can affect the heart ” (英語). Harvard Health . 2022年7月21日 閲覧。 ^ 大谷朋仁 (2021-01-01). “頻脈誘発性心筋症” (英語). 医学のあゆみ 277 (5): 413–417. ISSN 0039-2359 . https://www.pieronline.jp/content/article/0039-2359/277050/413 .
拡張型心筋症 (DCM) 関連
肥大型心筋症 (HCM) 関連
拘束型心筋症 (RCM) 関連
不整脈原性右室心筋症関連