細胞周期の段階。R点は間期 のG1 期に位置する。 制限点 (せいげんてん、英 : restriction point )またはR点 は、細胞周期 のG1 期 に位置する細胞周期チェックポイント である。細胞が細胞周期の進行に従事するようになる時点であり、これ以降は増殖の刺激のために細胞外のシグナルは不要となる[ 1] Start とも呼ばれる。R点はしばしばG1 /S期チェックポイント (G1 /S checkpoint)と同一視されるが、両者が同一ものであるのか2つの異なるポイントが存在するのかに関しては議論がある[ 2] [ 3] [ 4] [ 5] 1 /S期およびS期 サイクリン -CDK 複合体の活性化であり、この複合体はDNA複製 や中心体 複製、その他細胞周期の初期のイベントを開始するタンパク質をリン酸化 する[ 3]
ハワード・マーティン・テミン は、ニワトリの細胞がDNA複製に従事する時点に到達すると、細胞外のシグナルに依存しなくなることを示した[ 6] アーサー・パーディー (英語版 ) 1 期に存在することを実証した。それまで、G1 期は単に有糸分裂とS期の間の期間として定義されており、細胞がG1 期内のどの時点に位置しているかを示す分子的、形態的なマーカーは知られていなかった。パーディーは細胞を特定の細胞周期阻害条件(重要なアミノ酸の除去や血清の除去など)から他の阻害条件に移行させることで、各阻害要因がS期への進行を阻止する効率を比較した。その結果、いずれの要因もS期への移行を阻止する効率が同じであることが示された。このことはこれらの要因がすべてG1 期の同じ時点で作用していることを示唆しており、彼はその時点を制限点(restriction point)またはR点(R-point)と命名した[ 7]
1985年、ZetterbergとLarssonは、細胞周期のすべての段階で、血清の除去によってタンパク質合成が阻害されることを発見した。そして有糸分裂後の細胞(すなわちG1 期初期の細胞)のみが血清の除去によって静止期(G0 期 )に移行した。またZetterbergは、細胞周期の長さのばらつきのほとんどすべてに関して、R点からS期に移行するまでの時間で説明できることを発見した[ 8]
初期胚発生を除いて、多細胞生物の大部分の細胞はG0 期と呼ばれる静止状態にあり、増殖は行われず、一般的には終末分化した状態にある。そして成体でも分裂を継続するのは、他の特殊化した細胞である。どちらの細胞集団においても、細胞周期を出て静止状態(G0 期)へ移行するか、G1 期に再移行するかの決定が行われる。
細胞周期の進行または再移行の決定はS期より前のG1 期のR点と呼ばれる場所で行われ、細胞外から促進性や抑制性のシグナルを受け取り、処理することで決定される。R点以前の細胞は、G1 期の最初の3つのサブフェーズ(competence、 G1a (entry)、G1b (progression )などと呼ばれる)の進行のために、こうしたの細胞外の刺激因子を必要とする。しかし、G1b 期のR点を通過すると細胞外のシグナルはもはや必要なくなり、細胞は不可逆的にDNA複製の準備に従事し、これ以降の進行は細胞内の機構によって調節されるようになる。細胞がR点に到達する前に刺激因子を除去すると、細胞は静止状態へ戻ることがある[ 1] [ 6] [ 6]
成長因子 (PDGF 、FGF 、EGF など)は、細胞周期への移行とR点への進行を調節する。このスイッチ的な「回帰不能点」を通過した後は、細胞周期の完了は分裂促進因子の存在に依存しなくなる[ 7] [ 9] [ 10] 1 期サイクリン(サイクリンD )とCDK4 /6 との組み立てを調節することで細胞周期への移行を促進するが、その作用はMAPK 経路とPI3K 経路の双方を介して行われている可能性がある。
細胞外の成長因子が対応する受容体型チロシンキナーゼ (RTK)に結合すると、RTKのコンフォメーション変化が開始され、二量体化とチロシン 残基の自己リン酸化 が促進される。リン酸化されたチロシン残基はSH2ドメイン を含むタンパク質(Grb2 など)のドッキングを促進し、その後これらは他のシグナル伝達タンパク質を細胞膜 へリクルートし、シグナル伝達キナーゼカスケードを開始する。RTKに結合したGrb2はSos (英語版 ) グアニンヌクレオチド交換因子 であり、膜結合型のRas を活性型へ変換する(Ras-GDP
⟶
{\displaystyle \longrightarrow }
[ 11] Raf を結合して活性化し、RafはMEK をリン酸化して活性化し、MEKはERK (MAPKとしても知られる)をリン酸化して活性化する(MAPK/ERK経路 (英語版 )
活性型ERKは核 へ移行し、そこで転写因子 である血清応答因子 (SRF)などの複数の標的を活性化し、最初期遺伝子 、特に転写因子Fos やMyc などの発現を引き起こす[ 11] [ 12] Jun 二量体は転写因子複合体AP-1 を構成し、主要なG1 期サイクリンであるサイクリンD1 など遅れて応答する遺伝子群の活性化を担う[ 11] サイクリンD2 やCDK4の誘導の一部も担う[ 8] CDK2 のリン酸化と核局在に重要なようであり[ 11]
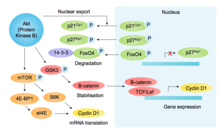
他のSH2ドメイン含有タンパク質p85は活性化されたRTKに結合してPI3Kをリクルートし、PI3Kはリン脂質 PIP2 をPIP3 へリン酸化しAkt のリクルートを行う。Aktは増殖や生存の促進機能に加えて、GSK3β を阻害してGSK3βを介したリン酸化とその後のサイクリンD1の分解を防ぐ[ 13] mTOR を介したサイクリンD1の翻訳 の促進[ 14] CDK阻害因子 (CKI)であるp27Kip1 とp21Cip1 のリン酸化(それぞれ核移行の阻害と安定性の低下を引き起こす)、p27の発現を調節する転写因子FOXO4 のリン酸化による不活性化[ 15] 1 /S期の移行を調節する。こうしたサイクリンD1の安定化とCKIの不安定化はG1 期、G1 /S期サイクリン-CDKの活性を補助する。
Aktシグナルはサイクリン/CDKの活性を促進する[ 16]
サイトカイン TGF-β などの抗増殖因子はR点の通過を阻害し、G1 期での停止を引き起こす。TGF-βシグナルはSmad を活性化し、SmadはE2F4 (英語版 ) 5 (英語版 ) p15INK4b の発現を活性化してサイクリンD/CDK複合体の形成と活性を阻害する[ 11] [ 17] Kip1 とp21Cip1 も蓄積している[ 17]
上述したように、細胞外の成長因子からのシグナルは古典的手法で伝達される。成長因子は細胞表面の受容体に結合し、さまざまなリン酸化カスケードによってCa2+ の取り込みとタンパク質のリン酸化が引き起こされる。タンパク質のリン酸化レベルは、ホスファターゼ との平衡となっている。そして最終的に、特定の標的遺伝子の転写活性化が生じる。細胞外シグナルは持続的である必要があり、細胞は迅速なタンパク質合成を支えるために十分な栄養供給を受ける必要がある。また、サイクリンDの蓄積も必要不可欠である[ 18]
サイクリンDに結合したCDK4やCDK6はCDK活性化キナーゼ (英語版 ) 1/2 <25 min)。この迅速なターンオーバーのため細胞は分裂促進シグナルのレベルに対してきわめて敏感であり、こうしたシグナルはサイクリンDの産生を促進するだけでなく、細胞内のサイクリンDの安定化も助ける[ 18] [ 19] [ 19] INK4 タンパク質やp21などのCKIは不適切なサイクリン/CDK活性を防ぐ役割を果たす。
活性型のサイクリンD/CDK複合体は核内でRbタンパク質 (pRb)をリン酸化する。リン酸化されていないpRbは、E2F を介した転写を妨げることでG1 期の阻害因子として作用する。pRbがリン酸化されると、E2FはサイクリンE やサイクリンA の転写を活性化する[ 18] [ 19] [ 20] [ 21]
p27とp21はG1 /S期、S期サイクリン/CDK複合体の化学量論的阻害因子である。p21のレベルは細胞周期への移行時に上昇するのに対し、p27は一般的に細胞がG1 期の終盤へ進行するにつれて不活性化される[ 11] [ 17] ERK2 やAktの活性はp21を不活性化させるリン酸化を引き起こす[ 22]
p27の過剰発現による初期の研究では、in vitro と特定の細胞種において、p27はサイクリンD-CDK4/6複合体とサイクリンE/A-CDK2複合体に結合して阻害を行うことが示唆された[ 17] [ 23] -/- p21-/- マウス胎児線維芽細胞ではサイクリンD/CDK4複合体の形成が低下しており、p27の再発現によってレスキューされることが示され、p27がサイクリンD/CDK複合体の形成に必要である可能性が示された[ 24]
さらに、p27はサイクリンD-CDK4/6複合体に結合したまま、チロシン 残基のリン酸化によって阻害型と非阻害型の切り替えが行われることが示唆され、p27によるサイクリン/CDK複合体の組み立てと活性の双方の調節機構に関するモデルが示された[ 25] [ 11] [ 26] ユビキチン化 、そして分解を促進する。
R点にはE2Fによるヒステリティック な双安定 スイッチが存在していることが示されている。E2Fは自身の活性化を促進するとともに自身の阻害因子であるpRbの阻害も促進し、双安定系の確立に重要な2つのフィードバックループを形成する。この研究ではE2Fプロモーターの制御下に置かれた不安定化GFP を利用してE2F活性の読み出しが行われ、血清飢餓細胞をさまざまな血清濃度で刺激することでGFPの読み出しが一細胞レベルで記録された。その結果、解析されたさまざまな血清濃度においてGFPレポーター はオンかオフかのいずれかの状態であり、完全に活性化されているか不活性化されているかのいずれかであることが示された。さらに、このE2F系の履歴依存性を分析した実験では、E2F系ががヒステリティックな双安定スイッチとして動作していることが確認された[ 27]
R点の正常な機能が破壊されると、細胞は継続的にそして不適切に細胞周期へ再移行し、G0 期へ移行しなくなるため、がん が生じる可能性がある[ 1] 老化 を回避できるようになる[ 20]
R点は、新しい薬物療法の開発において重要である。正常な生理状態では、すべての細胞の増殖はR点によって調節されている。このことは、非がん細胞を化学療法 による治療から守る方法として利用することができる。化学療法薬は通常、急速に増殖している細胞を攻撃するため、成長因子受容体阻害剤 (英語版 ) [ 19]
^ a b c “G1 events and regulation of cell proliferation”. Science 246 (4930): 603–8. (November 1989). Bibcode : 1989Sci...246..603P . doi :10.1126/science.2683075 . PMID 2683075 .
^ Lodish, Harvey; Berk, Arnold; Zipursky, S Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000). Molecular cell biology ISBN 978-0-7167-3136-8 . https://archive.org/details/molecularcellbio00lodi ^ a b Morgan, David Owen (2007). The cell cycle : principles of control ISBN 978-0-19-920610-0 . OCLC 70173205 . https://www.worldcat.org/oclc/70173205
^ “Regulation of G1 Cell Cycle Progression: Distinguishing the Restriction Point from a Nutrient-Sensing Cell Growth Checkpoint(s)” . Genes & Cancer 1 (11): 1124–31. (November 2010). doi :10.1177/1947601910392989 . PMC 3092273 . PMID 21779436 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3092273/ . ^ “What is the restriction point?”. Current Opinion in Cell Biology 7 (6): 835–42. (December 1995). doi :10.1016/0955-0674(95)80067-0 . PMID 8608014 . ^ a b c “What is the restriction point?”. Current Opinion in Cell Biology 7 (6): 835–42. (December 1995). doi :10.1016/0955-0674(95)80067-0 . PMID 8608014 .
^ a b “A restriction point for control of normal animal cell proliferation” . Proceedings of the National Academy of Sciences of the United States of America 71 (4): 1286–90. (April 1974). Bibcode : 1974PNAS...71.1286P . doi :10.1073/pnas.71.4.1286 . JSTOR 63311 . PMC 388211 . PMID 4524638 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC388211/ .
^ a b “Kinetic analysis of regulatory events in G1 leading to proliferation or quiescence of Swiss 3T3 cells” . Proceedings of the National Academy of Sciences of the United States of America 82 (16): 5365–9. (August 1985). Bibcode : 1985PNAS...82.5365Z . doi :10.1073/pnas.82.16.5365 . JSTOR 25651 . PMC 390569 . PMID 3860868 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC390569/ .
^ “The restriction point of the cell cycle”. Cell Cycle 1 (2): 103–10. (2002). doi :10.4161/cc.1.2.108 . PMID 12429916 . ^ “A restriction point for control of normal animal cell proliferation” . Proceedings of the National Academy of Sciences of the United States of America 71 (4): 1286–90. (April 1974). Bibcode : 1974PNAS...71.1286P . doi :10.1073/pnas.71.4.1286 . PMC 388211 . PMID 4524638 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC388211/ . ^ a b c d e f g Morgan, David Owen (2007). The cell cycle : principles of control ISBN 978-0-19-920610-0 . OCLC 70173205 . https://www.worldcat.org/oclc/70173205
^ “Transcriptional regulation and transformation by Myc proteins”. Nature Reviews. Molecular Cell Biology 6 (8): 635–45. (August 2005). doi :10.1038/nrm1703 . PMID 16064138 . ^ “Glycogen synthase kinase-3beta regulates cyclin D1 proteolysis and subcellular localization” . Genes & Development 12 (22): 3499–511. (November 1998). doi :10.1101/gad.12.22.3499 . PMC 317244 . PMID 9832503 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC317244/ . ^ “Upstream and downstream of mTOR”. Genes & Development 18 (16): 1926–45. (August 2004). doi :10.1101/gad.1212704 . PMID 15314020 . ^ “Ubiquitylation and proteasomal degradation of the p21(Cip1), p27(Kip1) and p57(Kip2) CDK inhibitors” . Cell Cycle 9 (12): 2342–52. (June 2010). doi :10.4161/cc.9.12.11988 . PMC 3319752 . PMID 20519948 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3319752/ . ^ “Molecular Pathways: Targeting the Cyclin D-CDK4/6 Axis for Cancer Treatment”. Clinical Cancer Research 21 (13): 2905–10. (July 2015). doi :10.1158/1078-0432.CCR-14-0816 . PMID 25941111 . ^ a b c d “Mechanisms of TGF-beta signaling from cell membrane to the nucleus”. Cell 113 (6): 685–700. (June 2003). doi :10.1016/S0092-8674(03)00432-X . PMID 12809600 .
^ a b c “Inhibitors of mammalian G1 cyclin-dependent kinases”. Genes & Development 9 (10): 1149–63. (May 1995). doi :10.1101/gad.9.10.1149 . PMID 7758941 .
^ a b c d Blagosklonny, Mikhail V.; Pardee, Arthur B. (2001). “The Restriction Point of the Cell Cycle” . In Blagosklonny, Mikhail V.. Cell Cycle Checkpoints and Cancer . Austin: Landes Bioscience. pp. 52–?. ISBN 978-1-58706-067-0 . https://www.ncbi.nlm.nih.gov/books/NBK6318/
^ a b “To cycle or not to cycle: a critical decision in cancer”. Nature Reviews. Cancer 1 (3): 222–31. (December 2001). doi :10.1038/35106065 . PMID 11902577 .
^ “Understanding the role of thyroid hormone in Sertoli cell development: a mechanistic hypothesis”. Cell and Tissue Research 322 (1): 133–40. (October 2005). doi :10.1007/s00441-005-1082-z . PMID 15856309 . ^ “CDK inhibitors: positive and negative regulators of G1-phase progression”. Genes & Development 13 (12): 1501–12. (June 1999). doi :10.1101/gad.13.12.1501 . PMID 10385618 . ^ “New functional activities for the p21 family of CDK inhibitors”. Genes & Development 11 (7): 847–62. (April 1997). doi :10.1101/gad.11.7.847 . PMID 9106657 . ^ “The p21(Cip1) and p27(Kip1) CDK 'inhibitors' are essential activators of cyclin D-dependent kinases in murine fibroblasts” . The EMBO Journal 18 (6): 1571–83. (March 1999). doi :10.1093/emboj/18.6.1571 . PMC 1171245 . PMID 10075928 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1171245/ . ^ “Differential modification of p27Kip1 controls its cyclin D-cdk4 inhibitory activity” . Molecular and Cellular Biology 28 (1): 498–510. (January 2008). doi :10.1128/MCB.02171-06 . PMC 2223302 . PMID 17908796 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2223302/ . ^ “CDK4/6 Inhibition in Cancer: Beyond Cell Cycle Arrest” . Trends in Cell Biology 28 (11): 911–925. (November 2018). doi :10.1016/j.tcb.2018.07.002 . PMC 6689321 . PMID 30061045 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6689321/ . ^ “A bistable Rb-E2F switch underlies the restriction point”. Nature Cell Biology 10 (4): 476–82. (April 2008). doi :10.1038/ncb1711 . PMID 18364697 .