|
三中心二電子結合三中心二電子結合(さんちゅうしんにでんしけつごう、英: three-center two-electron bond)とは、電子不足な化合物に現れる化学結合の様式のひとつで、3個の原子が2個の電子を共有しながら結びついている状態である。3c-2e と略記される。 三中心結合の考え方では、3個の原子がそれぞれ1個ずつ原子軌道を与え、3個の分子軌道、つまり結合性軌道と非結合性軌道と反結合性軌道を形成する。2個の電子がその結合性軌道へ入ると、3個の原子を結びつける結合力を生み出す。多くの場合、結合性軌道は3個の原子に均等に配置するのではなく、2個の原子の上に偏っている。また、3個の原子の並びはバナナのように曲がっており、バナナ型結合と称される。 化合物の例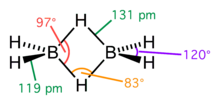 三中心二電子結合は、ジボラン (B2H6) などさまざまなホウ素化合物に見られる。ボラン (BH3) は単独ではオクテット則を満たさず不安定である。それを解消するために三中心二電子結合 (B-H-B) を作りながら二量化しジボランとなる。ジボランの6個の水素のうち両端の4個は通常の二中心二電子結合によりホウ素と B-H 結合を作っており、残りの2個が三中心二電子結合によりホウ素間を架橋している。 同様の結合様式はトリメチルアルミニウム (Al(CH3)3) にも見られる。この化合物ではメチル基が架橋した Al-C-Al 三中心二電子結合を作り二量体 Al2(CH3)6 を与える。 カルボカチオンを中心とする超共役において、三中心二電子結合の寄与を考えることができる。また、カルボカチオン型の転位反応(ワーグナー・メーヤワイン転位)では、その遷移状態に三中心二電子結合が現れる。その安定化効果は転位反応を円滑に進める要因となっている。 ノルボルニルカチオンなどの非古典的カルボカチオンは、3個の炭素が2個の電子を介して結びつく三中心二電子結合で説明される。プロトン化水素分子 (H3+) では3個の陽子と2個の電子の間で三中心二電子結合が働いている。 関連項目 |