|
ホモ芳香族
有機化学において、ホモ芳香族 (ホモほうこうぞく、英: homoaromatics) は、単一のsp3混成炭素原子によって共役が途切れている特殊な芳香族を意味する。伝統的には芳香族性はp軌道が連続的に続いているときにのみ発現するものとされているが、 sp3中心によりその連続性が途切れているにもかかわらず、芳香族化合物のような熱力学的安定性、分光学的性質、磁気的性質、化学的性質を示す化合物が存在する。形式的な不連続性を飛び超えてp軌道の重なりがあり、連続なπ電子軌道の環が維持される場合にこのような化学的安定性が発現する[1]。  ホモ芳香族という概念は、1959年にソウル・ウィンスタインの「トリス-ホモシクロプロペニルカチオン」の研究中で初めて提唱された[2]。ウィンスタインの論文の発表後、これらの分子の理解と分類に関する様々な研究がなされ、結果として芳香族に新しい分類が加えられ、芳香族の定義は絶えず拡張されることとなった。現在までに、カチオン性およびアニオン性のホモ芳香族化合物の存在が知られている。また、中性のホモ芳香族分子の存在を支持する研究もあるが、あまり一般的でない[3]。「ホモトロピリウムカチオン」(C8H+ 概要命名「ホモ芳香族」とは、ホモ芳香族化合物と、それ以前に論文に発表のあったホモ共役アルケンとの構造的類似性から派生した用語である[2]。The IUPAC Gold Bookでは、ホモ芳香族化合物が二つや三つ、それ以上のsp3 中心が別々に芳香族の共役系を遮っていることを示すために、ビス- (Bis-)、トリス- (Tris-)、等の接頭辞を使うよう求めている。 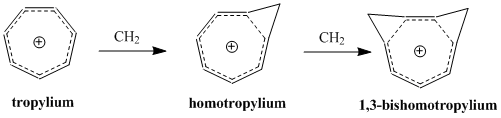 歴史ホモ芳香族性の概念は、1950年代に引き起こった非古典カルボニウムイオンにまつわる論戦に端を発する。非古典イオンモデルの提唱者として有名なソウル・ウィンスタインの、3-ビシクロ[3.1.0]ヘキシルカチオン研究中に初めてホモ芳香族性が記述されている。 一連の加酢酸分解実験において、ウィンスタインらは加溶媒分解反応がトシル脱離基がエカトリアル位にあるときに経験的により速く進行することを発見した。彼らは、この反応速度の違いはシス異性体で生じる隣接基補助効果によるものであるとした。したがって、この結果はこのカチオンに非古典構造があることを支持するものである[4]。 ウィンスタインは続いて、この3-ビシクロ[3.1.0]ヘキシルカチオンの非古典モデルが以前に良く研究されていた芳香族、シクロプロペニルカチオンと類似しているこに気付いた。シクロプロペニルカチオンと同様、正電荷は3つの、2つずつπ電子を持つ等価な炭素上に非局在化していた。この電子配置はしたがって芳香族性についてのヒュッケル則(4n+2 個のπ電子を要求する)を満たす。実際、ウィンスタインはプロペニルカチオンと彼の唱える非古典ヘキシルカチオンの違いが、後者では3つの -CH2- 基により共役系が寸断されている以外には基本的にないことを見出した。そこで、彼らはシクロプロペニルカチオンのトリス-ホモ相対物であるということで、「トリス-ホモシクロプロペニル」という名前を提案した。 ホモ芳香族性の証拠ホモ芳香族性の基準芳香族性の基準は、これらの有機分子の際立った安定性への理解についての新たな発展と知見が進むにつれて拡張されてきた[5]。このため、これらの分子に要求される特性は議論の的になり続けてきた。古典的には、芳香族化合物は環状に非局在化した (4n+2) 個のπ電子を持ちヒュッケル則を満たす平面分子であると定義されてきた。最も重要なのは、これらの環状共役系が、局在化した共鳴構造に基いた予測に比べて、飛び抜けた熱化学的安定性を示すということである。簡潔には、次の3つの重要な特徴が芳香族化合物を特色づけている[6]。 しかし、慣用的な規則には数々の例外が存在する。メビウス 4n π電子種やペリ環状遷移状態、(π結合ではなく)σ結合を通した非局在化電子の循環、多遷移金属サンドイッチ分子などなどの多くの分子が、芳香族性の慣用的パラメータからはいくらか外れるにもかかわらず芳香族とみなされてきた[7]。 結果として、ホモ芳香族的非局在化の基準も同様に曖昧さを残しており、議論も続いている。ホモトロピリウムカチオン (C8H+ 初期のホモ芳香族の証拠ホモ芳香族構造の初めての報告、トリス-ホモシクロプロペニルカチオンがウィンスタインにより発表されて後、多くのグループが類似化合物の観察結果を報告し初めた。これらの中で最も研究された分子の一つがホモトロピリウムカチオンであり、その親化合物は1962年、 Pettit et al. によりシクロオクタテトラエンを強酸と反応させることにより安定な塩として初めて単離された[8]。初期のホモ芳香族性の証拠の多くは、この分子の非典型的NMR特性の観測に由来するものである。 NMR分光研究シクロオクタトリエンの脱水素化により生じたこの化合物を 1H NMR分光法を用いて調べていた際、彼らは同じメチレン架橋炭素に結合したプロトンに対応する共鳴が驚くほど違う化学シフトを示していることを観測した。  この観測結果から、Pettit et al. は古典的シクロオクタトリエニルカチオン構造は間違っていると結論づけた。そして、彼らはビシクロ[5.1.0]オクタジエニル化合物を提案し、八員環の内部に生じたシクロプロパン結合がそれなりの非局在化を受けているはずだと考えることで化学シフトの劇的な違いを理論的に説明した。さらなる考察の過程で、Pettit はむしろ、内部シクロプロパン結合を排して電子の非局在化のみをもつ、「ホモトロピリウムイオン」としてこの化合物を表現するようになった。この構造は非局在化が環状で、六つの π 電子を含むことによりヒュッケル則に合致している。よって、NMRの磁場により環状電流が誘起され、これによりメチレン基に結合しているexo位のプロトンとendo位のプロトンで共鳴に顕著な違いが現われる。Pettit et al. はこの化合物と芳香族であるトロピリウムイオンとの特筆すべき類似性を強調し、既知の芳香族に対するウィンスタインが予言した通りの新たな「ホモ相対物」としてこれを説明した。 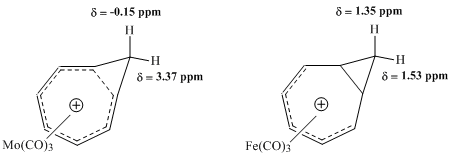 後のウィンスタイン他のNMR研究により、ホモトロピリウムイオンとの金属カルボニル錯体の物性が探られ、モリブデン錯体と鉄錯体との比較により特に興味深い結果が得られた。モリブデントリカルボニルはトリトロピリウムカチオンに配位時に6つのπ電子を受けとり、ホモ芳香族性を保つと予測された。対照的に、鉄トリカルボニルは配位時に四つのπ電子しか受け取ることができず、錯体中でカチオン上の電子は局在化する。これらの錯体を 1H NMR分光により研究した結果、メチレンプロトンの化学シフト値はモリブデン錯体においてホモ芳香族構造と矛盾しないが鉄錯体においては二つのプロトンは同等でほとんど共鳴に差がないことが検出された[9]。 紫外分光研究ホモトロピリウムカチオン構造を支持した初期の証拠のうち磁気的物性によらないものの重要な一部は、紫外(UV)スペクトルにより得られた。ウィンスタインらはホモトロピリウムカチオンの吸光ピークが古典的なシクロオクタテトラニルカチオンや内部シクロプロパン結合が完全に生じた(そして非局在化した電子状態を持つ)ビシクロ[5.1.0]オクタジエニル化合物に対して予測される値よりもかなり短波長にあらわれることをつきとめた。そして、UVスペクトルは芳香族トロピリウムイオンのものとよく似ていた。さらに計算することにより、ウィンスタインはとびでたメチレン基に隣接する二つの炭素原子の間の結合次数がトロピリウムカチオンにおける対応する炭素原子間の π結合と同程度であることを示した[10]。この実験は非常に明らかな結果をもたらしたが、一般的にはUVスペクトルは芳香族性およびホモ芳香族性の指標としてはあまりよくないとされることに注意が必要である[6]。 より新しいホモ芳香族性の証拠より新しくは、ホモ芳香族性トロピリウムイオンと称するものの構造を様々な実験的手法や理論的計算により調査する研究が行われている。重要な実験的手法の一つは、置換ホモトロピリウムイオンの結晶構造をX線回折により解析するものである。これらの結晶学的研究により、シクロプロペニル構造の底辺にあたる原子間の核間距離は実際に通常のシクロプロパン分子において予測される長さよりも長いこと、および外部結合の結合距離はより短いことが明らかにされた。この結果は、内部シクロプロパン結合が電荷非局在化の影響を受けていることを示している[6]。 分子軌道による説明ホモ芳香族の安定性を分子軌道の観点から説明する理論は様々なものがあるが、ほとんどはホモトロペニリウムカチオンを標準物質としている。Robert C. Haddonは最初はメチレン基の外部 sp3 電子が隣接炭素原子間結合に逆供与されることによる結合の安定化が起きているとするメビウスモデルを提唱した[11]。 摂動分子軌道論ホモ芳香族性は、1975年にRobert C. Haddonが発表した摂動分子軌道論 (Perturbation Molecular Orbital Theory, PMO) によってより良く説明ができる。ホモトロペニリウムカチオンは、元のトロペニリウムカチオンがホモ共役架橋により共鳴を乱され摂動を受けたものとして考えることができる[12]。  一次効果ホモ芳香族性特徴の中でも最も重要な因子は、親芳香族化合物への単一ホモ共役架橋付加である。全てのホモ芳香族種は、対称性をもち全ての炭素原子間の結合次数が等しい芳香族化合物からの誘導体であるから、ホモ共役結合の位置は重要ではない。ホモ共役架橋の挿入によりπ電子密度が δβ だけ摂動を受けるものとすると、この量は環のサイズに依存し、0と1の間の値をとる。 0は摂動が無いことを表わし、1は芳香族性が全く失われたこと(開環型と同等までの不安定化)を表わす[12]。環のサイズを大きくするにつれてホモ芳香族の共鳴安定化は、ホモ共役架橋の形成による歪みによって相殺されていくと考えられている。実際、ホモ芳香族環の最大サイズは16員環であるアヌレン環が歪んだ架橋ホモカチオンよりも芳香族ジカチオンを好むことからわかるように、かなり小さい[13]。 二次効果2つ目のホモ共役架橋ホモ芳香族性に関する摂動分子軌道論における大事な二次効果は、2つ目のホモ共役架橋の追加とそれによる安定性への影響である。この効果は通常、単一のホモ共役架橋の追加によりもたらされる不安定性の二倍となるが、2つの架橋の近さに依存する追加の項がある。δβ を最小化し、カップリング項を最小に保つために、ビスホモ芳香族化合物は、共鳴を最大化し立体障害を最小化する配座を形成する。シスビシクロ[6.1.0]ノナ-2,4,6-トリエンのプロトン化による1,3-ビスホモトロペニリウムカチオンの合成は、1番と3番の炭素にメチレン架橋を生じることにより安定性を最大化している[12]。  置換基ホモ芳香族化合物への置換基の付加は、化合物の安定性に大きな影響を与える。置換基とホモ共役架橋との相対位置に依存して、安定化効果と不安定化効果の両方が生じうる。この相互作用は置換トロペニリウムカチオンを調べることで最も良く明らかにすることができる。もし、電子供与性の誘起効果を持つ置換基がカチオンの1位または3位の炭素に結合した場合、その基は安定化効果をもたらし、その化合物のホモ芳香族的特徴を増強する。しかし、同じ置換基でも2位または4位の炭素に結合した場合は、置換基とホモ共役架橋との間の相互作用は不安定化効果をもたらす。したがって、メチルおよびフェニル置換基を持つシクロオクタテトラエンのプロトン化の反応物としては、ホモトロペニリウムカチオンの一つの異性体のみが生じる[12]。  ホモ芳香族化合物の例最初のホモ芳香族化合物の発見の後、類似の安定性を示す新たなホモ芳香族化合物の合成に向けて研究が進められた。ホモ芳香族化合物にはいくつかの分類が知られており、そのそれぞれが理論的に予測され、実験により確かめられた。 カチオン性ホモ芳香族最もよく確立され、よく知られているホモ芳香族種はカチオン性のホモ芳香族化合物である。前述のとおり、ホモトロペニリウムカチオンは最もよく研究されているホモ芳香族の一つである。シクロプロペニルカチオン、トロピリウムカチオン、シクロブタジエンジカチオンは強い芳香族的特徴を示すため、多くのカチオン性ホモ芳香族化合物がこれらを基礎としている[14]。 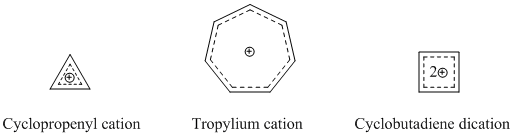 ホモトロピリウムカチオンに加えて、もう一つの確立されたカチオン性ホモ芳香族化合物はノルボルネン-7-イルカチオンが挙げられる。これは、理論的にも実験的にも強いホモ芳香族性を示すことが分かっている[15]。  興味深い、σビスホモ芳香族の例としてパゴダンのジカチオンが挙げられる。これらの四中心二電子系では、四つの炭素原子により定義される平面内で非局在化が起こっている(σビスホモ芳香族性を示唆する現象の最初の例は、シクロプロパンがこの効果により ~11.3 kcal/mol の安定性を獲得していることである[16])。このジカチオンはパゴダンの酸化、もしくは対応するビスセコドデカヘドラジエンの酸化により得られる(下図)[17]。 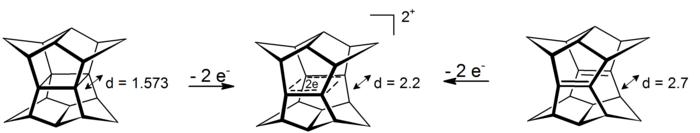 対応する6電子ジアニオンへの還元はいままでのところできていない[要出典]。 中性ホモ芳香族中性ホモ芳香族には多くの種類があるものの、それらが真にホモ芳香族的特徴を示しているのかどうかについては議論がある。中性ホモ芳香族の一種類として、シクロヘプタトリエンを始めとするモノホモ芳香族と呼ばれる種類があり、多くの複雑なモノホモ芳香族が合成されている。一つの特異的な例は、単一のメチレン架橋を持つフラーレン誘導体である。UVおよびNMR解析により、このフラーレン誘導体の芳香族的特徴はホモ共役架橋の付加によって損われておらず、したがってこの化合物はたしかにホモ芳香族であることが示されている[18]。 ビスホモ芳香族長いあいだ、中性ホモ芳香族の最もよい例はバレレンやセミブルバレンなどのビスホモ芳香族であるとされてきた。1966年に初めて合成された[19]セミブルバレンはホモ芳香族として考えるに十分な構造を持っていたが、セミブルバレン誘導体が真に非局在化された基底状態を持つホモ芳香族化合物であるのかどうかには議論があった。セミブルバレンを電子供与性基および電子求引性基で置換することにより非局在化された遷移状態をより安定化させるための努力がなされる中で、この転位反応の活性化障壁は低減することはできるものの除くことはできないことがわかった[20][21]。しかし、局在化した基底状態構造を不安定化させることを狙って、循環環化の戦略的な追加を通じて環状分子に歪みを導入することにより、非局在化されたホモ芳香族基底状態構造を実際に得ることができた[22]。 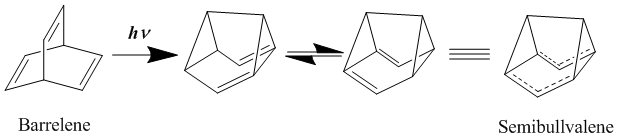 中性ホモ芳香族の中でも、中性ホモ芳香族性を示すことが最もよく信じられている化合物としてホウ素含有化合物である1,2-ジボレタンが挙げられる。置換ジボレタンは局在化構造よりも非局在化構造の方が極めて安定化されていることが示されており、ホモ芳香族性を強く示す証拠となっている[23]。電子供与性基が二つのホウ素原子に結合した場合は、その化合物は局在化された結合を持つ古典構造を好む。ホモ芳香族的特徴は、電子求引性基がホウ素原子に結合し、化合物が非局在化された非古典構造をとるようになったときに最もよく見られる。  トリスホモ芳香族名前の示す通り、トリスホモ芳香族はビスホモ芳香族よりも一つメチレン架橋が多く、全部で三つのホモ共役架橋を持つものとして定義される。セミブルバレンと同様、どの程度までトリスホモ芳香族がホモ芳香族的特徴を示すのかについては議論がある。理論的にはホモ芳香族とされるが、これらの化合物は非局在化による安定化がベンゼンの 5% に満たないことが知られている[24]。  アニオン性ホモ芳香族中性ホモ芳香族とは違い、アニオン性ホモ芳香族は広く「真の」ホモ芳香族であるとされている。これらアニオン性化合物はしばしば中性親化学種からリチウム金属還元により合成される。1,2-ジボレタニド誘導体は、中性古典構造における C-B 結合よりも短い結合を示す、ホウ素-ホウ素-炭素原子を通じてホモ芳香族的特徴を強く示す[25]。これらの1,2-ジボレタニド誘導体は、ある程度のホモ芳香族性を保ったままより環を大きく様々な置換基を持たせることができる。 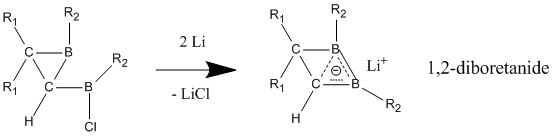 アニオン性ホモ芳香族性は、四中心(窒素)六電子系を含む、ビス-ジアゼンジアニオン化合物にもみられる。実験により、環間窒素-窒素距離が短くなることが示されており、このことはビス-ジアゼンジアニオンがビスホモ芳香族化合物であることを示している。この系に特有な特徴として、電子の環状非局在化が四つの窒素原子により定義される σ-平面内で起こっているということである。このように、これらビス-ジアゼン-ジアニオンは四中心六電子 σ-ビスホモ芳香族性の初めての例となった[26][27]。対応する二電子 σ-ビスホモ芳香族系はパゴダンジカチオンの形で実現されている(前述参照)。 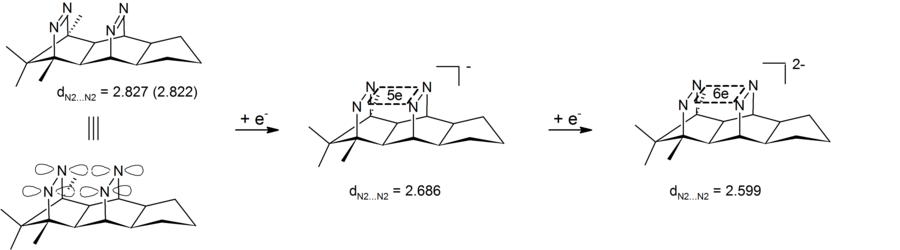 反ホモ芳香族性反ホモ芳香族性を示す化合物も報告されている。芳香族化合物が特異的安定性を示し、閉環内に4n個のπ電子を持ちヒュッケル則から外れる反芳香族化合物が比較的不安定であるのと全く同様である。架橋ビシクロ[3.2.1]オクタ-3,6-ジエン-2-イルカチオンは四つしかπ電子を持たないため、「ビスホモ反芳香族性」を示す。一連の理論的計算により、対応するアリルカチオンよりもより不安定であることが確かめられている[28]。 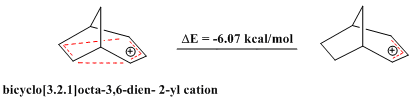 同様に、置換されたビシクロ[3.2.1]オクタ-3,6-ジエン-2-イルカチオン(2-(4'-フルオロフェニル) ビシクロ[3.2.1]オクタ-3,6-ジエン-2-イルカチオン)対応するアリルカチオンと比べて反芳香族性を示すことが理論的計算およびNMR解析から示されている[28]。  外部リンク出典
|
